Фактор эквивалентности вещества Х, участвующего в ионообменном процессе, равен
fэ (Х) = 1: (Ni·|zi|),
где Ni и zi - соответственно число и заряд ионов, которыми обменивается молекула реагирующего вещества со своим партнером.
Многоосновные кислоты НnА и многокислотные основания М(ОН)n имеют по n факторов эквивалентности: от 1 до 1/n. Если факторы эквивалентности соляной кислоты HCl и гидроксида натрия NаОН в обменных процессах всегда равны 1, то у серной кислоты Н2SО4 и гидроксида кальция Са(ОН)2 факторы эквивалентности равны 1 и 1/2, а у ортофосфорной кислоты Н3РО4 и гидроксида алюминия Аl(ОН)3 – 1, 1/2, 1/3.
Для солей фактор эквивалентности может быть найден по числу замещенных катионов или анионов.
Для солеобразующих оксидов фактор эквивалентности определяется числом катионов соответствующего оксиду основания или анионов соответствующей оксиду кислоты и их зарядом. В реакции между оксидом фосфора (V) и оксидом кальция
Р2О5 + СаО → Са3(РО4)2
фактор эквивалентности Р2О5, образующего два трехзарядных фосфат-иона (РО43-) равен 1/6, а для СаО, образующего один двухзарядный катион (Са2+), 1/2.
В некоторых реакциях молекулы одного вещества претерпевают разные превращения, например, одна часть молекул участвует в окислительно-восстановительном процессе, а другая часть молекул того же вещества – в процессе ионного обмена. Для такой реакции следует находить общий фактор эквивалентности, как сумму факторов эквивалентности, учитывающих каждое превращение данного вещества.
Пример 3.В нижеприведенных схемах реакций определите факторы эквивалентности исходных веществ:
а) LiOH + H3PO4 →Li2HPO4 + H2O
Молекула LiOH теряет в данной реакции один однозарядный ион ОН- , поэтому fэ (LiOH) = 1: (1·|-1|) = 1;молекула H3PO4 обменивается двумя однозарядными ионами Н+ , поэтому fэ (H3PO4) = 1: (2·|+1|) = 1:2.
б) Al2(SO4)3 +ВаCl2 →Ва SO4 + AlCl3
Величина fэ(Al2(SO4)3) может быть рассчитана либо по числу ионов алюминия, замещенных ионами бария, либо по числу сульфат-ионов, образующих с ионами бария осадок. И в том, и в другом случае результат одинаков:
fэ(Al2(SO4)3) = 1: (2·|+3|) = 1: (3·|-2|) = 1:6.
Величина fэ(ВаCl2)может быть рассчитана либо по числу ионов бария, замещенных ионами алюминия, либо по числу хлорид-ионов, образующих с ионами алюминия растворимую соль. fэ (ВаCl2)= 1: (1·|+2|) = 1: (2·|-1|) = 1:2.
в) ZnО + СО2 → ZnСО3
Величина fэ (ZnО), образующего один двухзарядный ион Zn 2+, равен 1/2;
fэ (СО2), образующего один двухзарядный ион (СО32-), равна 1/2.
г)Zn + Н2SO4 (конц.) → Н2S + Zn SO4 + Н2О
Превращаясь вН2S-2, молекула Н2S+6 O4 присоединяет 8 электронов, т.е. fэ = 1/8; а образуя Zn SO4, молекула Н2SO4 теряет два иона Н+, т.е. fэ = 1/2. Общий фактор эквивалентности fэ(Н2SO4) = 1/8 + 1/2 = 5/8.
Пример 4.Выразить эквивалентную массу оксида, гидроксида, сульфата и хлорида металла.
Решение.Эквивалентная массавещества в общем случае определяется по формуле (1.1). В частном случае ее можно представить как сумму эквивалентных масс составных частей молекулы или кристалла вещества.
1. Молекула или кристалл оксида любого элемента образованы атомами данного элемента и кислорода. Таким образом, эквивалентная масса оксида равна сумме эквивалентных масс элемента и кислорода:
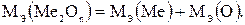
Согласно формуле (1.1)
Мэ(О) = fэ (О)·М(О) = 16:2 = 8 г/моль.

Следовательно,
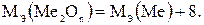 (1.2)
(1.2)
2. В состав гидроксида входят атомы металла и гидроксильные группы:

Согласно формуле (1.1)
Мэ(ОН-) = fэ (ОН-)·М(ОН-) = 17:1 = 17 г/моль.
Таким образом,

3. В молекулу сульфата металла входят ионы данного металла и сульфатные группы (SO4)2-:
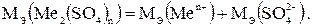
Согласно формуле (1.1)
Мэ(SO4 2-) = fэ (SO4 2-)·М(SO4 2-) = 96:2 = 48 г/моль.
Таким образом,

4. Эквивалентную массу хлорида металла определяют по аналогии с предыдущими случаями:

Мэ(Cl-) = fэ (Cl-)·М(Cl-) = 35,5:1 = 35,5 г/моль

Закон эквивалентов.Массы (объемы) реагирующих друг с другом или образующихся в результате реакции веществ пропорциональны их эквивалентным массам Мэ (эквивалентным объемам для газов Vэ):
m1: Мэ1 = m2: Мэ2 = V1: Vэ1= V2: Vэ2.
Пример 5.Оксид марганца содержит 22,56% кислорода. Найти эквивалентную массу и валентность марганца в этом соединении. Составить формулу оксида.
Решение. Пусть масса оксида марганца равна 100 г, тогда масса кислорода будет составлять 22,56 г. На основании закона эквивалентов можно составить следующую пропорцию:
 (1.3)
(1.3)
Примем Мэ(Мn) = А г/моль, тогда, согласно формулы (1.2), 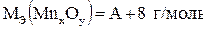 . Исходя из формулы (1.1),
. Исходя из формулы (1.1),  . Подставляя полученные значения в формулу (1.3), имеем
. Подставляя полученные значения в формулу (1.3), имеем
 .
.
Решая уравнение относительно А, получим А = 27,5 г/моль.
Валентность марганца (по модулю совпадающую со степенью окисления) определим по формуле, связывающей молярную и эквивалентную массы элемента (1.1),
Мэ(Mn) = fэ (Mn )·М(Mn ) = М(Mn ) : В (Mn ),
откуда

Так как в оксидах кислород двухвалентен, получаем следующую формулу оксида марганца: MnO.
Пример 6.Рассчитать массу сахарозы С12Н22О11, если на ее окисление до углекислого газа СО2 в присутствии серной кислоты израсходовано 100 г перманганата калия КМnО4 (в кислой среде образуется МnSО4).
Решение. В данной реакции степень окисления марганца изменяется от +7 (КМnО4) до +2 (МnSО4), а углерода – от 0 (С12Н22О11) до +4 (СО2). Следовательно, для перманганата калия fэ = 1/5, а для сахарозы 1/48, так как в ее молекулу входят 12 атомов углерода. Тогда Мэ (КМnО4) = 158:5 = 31,6 г/моль, и Мэ(С12Н22О11) =342:48 =7,1 г/моль.
Согласно закону эквивалентов

Тогда m(С12Н22О11) = m(КМnО4)·7,1/31,6 =710/31,6=22,45 г.
Газовые законы. Параметры состояния, единицы измерения: V – объем, м3; Р – давление, Па; Т – температура, К; m – масса газа, кг; М – молярная масса газа, кг/моль; Мэ – молярная масса эквивалента газа, кг/моль; R – универсальная газовая постоянная, R = 8,314 Дж/(моль·К).
Нормальные условия (н.у.): 273,15 К(0 °С); 1,0133·105 Па (760 мм рт.ст.).
Объединенный газовый закон: р·V/Т = const.
Уравнение Клапейрона - Менделеева: р·V = m RТ/М.
Закон Авогадро: В равных объемах любых газов при одинаковых условиях (температура и давление) содержится одинаковое число соответствующих структурных единиц (молекул или атомов).
Дата добавления: 2016-01-09; просмотров: 1950;
