ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА. Для прогнозирования физико-химических процессов очень важно заранее знать, возможна ли реакция между теми или иными веществами
Для прогнозирования физико-химических процессов очень важно заранее знать, возможна ли реакция между теми или иными веществами, приведенными в химический контакт. В случае, если реакция в данных условиях невозможна, то какие для ее протекания необходимы температура и давление, каков при этом окажется состав равновесной смеси и давление. Не менее важны сведения о тепловых эффектах химических реакций, особенно для оценки теплотворной способности различных видов топлива. Или, например, почему одновременно могут протекать два противоположных процесса – фотосинтез и горение? Ответы на все эти вопросы позволяет найти химическая термодинамика.
Термодинамика – наука о превращениях энергии. Химическая термодинамика применяет законы термодинамики к свойствам и поведению веществ в химических реакциях. Они определяются через изменение соответствующих термодинамических параметров состояния системы, к которым относятся:
- внутренняя энергия U – полная энергия частиц, составляющих данное вещество; она слагается из кинетической энергии поступательного, колебательного и вращательного движения частиц, а также потенциальной энергии сил притяжения и отталкивания, действующих между частицами;
- энтальпия системы Н – термодинамическая функция, характеризующая систему, находящуюся при постоянном давлении, Н=U+pV, где p и V – соответственно давление и объем системы;
- энтропия S и ее изменение DS, являющиеся мерой структурной неупорядоченности системы, Дж/(моль×К);
- свободная энергия Гельмгольца (F) и ее изменение D F, которые являются рой химического сродства и критерием самопроизвольного протекания изохорно-изотермических процессов, кДж/моль;
- свободная энергия Гиббса G и ее изменение DG, которые являются мерой химического сродства и критерием самопроизвольного протекания изобарно-изотермических процессов, кДж/моль.
Соотношения между перечисленными параметрами можно выразить следующей схемой:


H (ΔH)

U (∆U) РV (Р∆V)


ТS (Т∆S) G (∆G)


ТS (Т∆S)F(∆F)РV (Р∆V)




Из данной схемы можно легко построить любое термодинамическое уравнение, например:
∆F = ∆Н - Т∆S - Р∆V.
Термохимия
Термохимия изучает тепловые эффекты химических процессов. Протекание химических реакций всегда связано с выделением или поглощением теплоты. Химические реакции, в результате которых выделяется теплота, называются экзотермическими, химические реакции, протекающие с поглощением теплоты, называются эндотермическими. При химических процессах может выделяться или поглощаться не только тепловая, но и другие виды энергии: электрическая, световая, механическая и др. Различные виды энергии, выделяемой или поглощаемой в ходе процесса, пересчитывают на тепловую энергию, выражая ее количество в килоджоулях (кДж).
Количество энергии относят к такому числу молей вещества, которое указано в уравнении реакции, и называют его тепловым эффектом (теплотой) Q реакции. Уравнения реакций, в которых указываются тепловые эффекты, называются термохимическими. Так как тепловой эффект зависит от состояния вещества, то в термохимических уравнениях указывают их фазовое состояние.
Для реакций, протекающих при постоянном давлении и постоянной температуре, тепловой эффект равен изменению энтальпии с противоположным знаком: Qр =-DН, кДж/моль, а при постоянном объеме он равен изменению внутренней энергии с противоположным знаком: QV =-D U.
Тепловой эффект реакции образования одного моля вещества из простых веществ называется теплотой образования DН данного вещества. Энтальпию образования 1 моля сложного вещества из простых веществ, измеренную при температуре 298 К и давлении 101,325 кПа, называют стандартной энтальпией образования 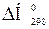 , кДж/моль. Энтальпии простых веществ (О2, Н2, S и т.п.) условно принимают равными нулю.
, кДж/моль. Энтальпии простых веществ (О2, Н2, S и т.п.) условно принимают равными нулю.
Термохимические расчеты осуществляют, применяя следствие из закона Гесса: тепловой эффект химической реакции DНх.р равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ, с учетом коэффициентов перед формулами этих веществ в реакции:
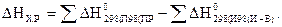 .
.
Пример 1. Вычислить тепловой эффект, написать термохимическое уравнение горения 1 моля метана и рассчитать количество теплоты, которое выделится при сгорании 10 л CH4.
Решение.Составим термохимическое уравнение реакции
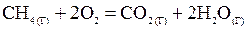
Выпишем стандартные теплоты образования 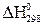 веществ (прил. 3):
веществ (прил. 3):
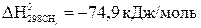 ,
,
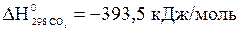 ,
,
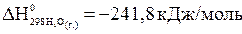 .
.
Тепловой эффект реакции вычислим, используя следствие закона Гесса:
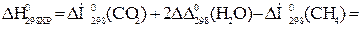
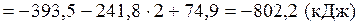
При сжигании 22,4 л выделяется 802,2 кДж, при сжигании 10 л выделяется х кДж. Составим и решим пропорцию:
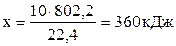 .
.
Ответ: 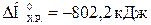 , при сжигании 10 л метана выделяется 360 кДж.
, при сжигании 10 л метана выделяется 360 кДж.
Дата добавления: 2016-01-09; просмотров: 943;
