Химическое равновесие
При некоторой температуре энтальпийный и энтропийный факторы уравниваются, две противоположные тенденции уравновешивают друг друга, т.е. ΔΗ = ΤΔS. В этом случае соблюдается условие DGх.р=0, которое является термодинамическим условием химического равновесия.
Химическое равновесие имеет динамический характер. Скорость реакции (число частиц, образующихся в единицу времени в единице объема) в прямом направлении равна скорости реакции в обратном направлении. В условиях химического равновесия концентрации (или парциальные давления в случае газов) исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями (или парциальными давлениями) веществ. В дальнейшем, равновесные концентрации обозначены символом вещества в квадратных скобках, например, [А]¸ [В], моль/дм3. Равновесное парциальное давление обозначено индексом р, например, ррА.
Для реакции, протекающей по уравнению:
аА(г) + bВ(г) ↔ cC(г)+ dD(г)
математическое выражение закона действующих масс может быть представлено в двух вариантах:
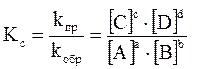 – аналитическая константа равновесия;
– аналитическая константа равновесия;
или
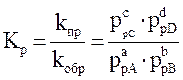 – термодинамическая константа равновесия.
– термодинамическая константа равновесия.
Если все реагенты газообразны и их поведение подчиняется законам идеальных газов, то связь между Кр и Кс можно выразить уравнением
Кр = КС(RT)Δν,
где Δν – изменение числа молей газов в результате реакции
Δν = (с+d) – (а+b).
Термодинамическая константа может быть рассчитана, если известно стандартное значение энергии Гиббса:
lgКр = -DG0 /(2,303RT).
Как следует из вышесказанного, константа равновесия зависит от температуры. С учетом сущности понятия DG0 уравнение принимает вид
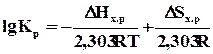 .
.
Если нет фазовых превращений компонентов реакции, то при увеличении температуры слагаемое 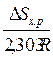 ≈const, тогда при возрастании температуры для экзотермической реакции (DН<0) константа равновесия уменьшается, а для эндотермической реакции (DН>0) – увеличивается.
≈const, тогда при возрастании температуры для экзотермической реакции (DН<0) константа равновесия уменьшается, а для эндотермической реакции (DН>0) – увеличивается.
Каждое химическое равновесие устанавливается при определенном значении трех параметров, которые его характеризуют: 1) концентрация реагирующих веществ и продуктов реакции; 2) температура; 3) давление (для газов). При изменении любого из этих параметров равновесие может смещаться. Смещение равновесия определяется принципом Ле-Шателье: при всяком внешнем воздействии на систему, находящуюся в состоянии химического равновесия, в ней протекают процессы, приводящие к уменьшению оказанного воздействия.
Принцип Ле-Шателье следует из закона действующих масс. Если система находится при постоянной температуре, то константа равновесия при внешних воздействиях остается постоянной. Поэтому любое изменение равновесных концентраций одного или нескольких веществ должно приводить к такому изменению равновесных концентраций других веществ, чтобы соблюдалось постоянство константы равновесия.
Пример 3.Рассмотреть принцип Ле-Шателье на примере реакции получения водорода конверсией метана:
СН4 + 2Н2О(г) = СО2 + 4Н2 ΔΗ>0
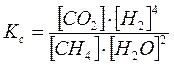 .
.
Решение.
1. Влияние концентраций (парциальных давлений) компонентов системы. Если, например, в систему добавить метан, т.е. увеличить его концентрацию, то равновесие системы нарушится. При этом ускорится прямая реакция, что приведет к увеличению концентрации продуктов реакции СО2 и Н2 и уменьшению концентрации водяного пара, т.е. равновесие смещается вправо. Процесс будет протекать до тех пор, пока не установится новое равновесие, характеризующееся тем же значением Кс. Если в систему ввести дополнительное количество СО2 или Н2, то в соответствии с принципом Ле-Шателье равновесие сместится влево.
2. Влияние общего давления в системе. Если в результате реакции изменяется число молей газообразных веществ, то изменение общего давления в системе вызывает смещение равновесия. В соответствии с принципом Ле-Шателье увеличение общего давления в системе вызывает смещение равновесия в сторону уменьшения числа молей газообразных веществ, т.е. в сторону уменьшения давления. Для рассматриваемой реакции увеличение давления должно смещать равновесие влево (слева Σνi = 3, справа Σνi = 5).
3. Влияние температуры. С увеличением температуры равновесие смещается в сторону эндотермических реакций, т.е. реакций, протекающих с поглощением теплоты. Как указывалось ранее, повышение температуры вызывает увеличение константы равновесия эндотермической реакции, а соответственно возрастают отношения концентраций продуктов реакции к концентрациям исходных веществ, т.е. равновесие смещается в сторону эндотермических реакций. Например, увеличение температуры вызывает смещение равновесия рассматриваемой реакции получения водорода (ΔΗ>0) в правую сторону, а для экзотермической реакции
2Н2 + О2 = 2Н2О (ΔΗ<0)
– в левую сторону.
Пример 4.Равновесие в гомогенной газовой системе 2А+3В«3С+D установилось в момент, когда прореагировало 50% вещества А. Вычислить константу равновесия, если концентрации исходных веществ С0А=0,6 моль/л и С0В = 1,0 моль/л. В какую сторону сместится равновесие при повышении давления?
Решение.Для расчета константы равновесия необходимо найти равновесные концентрации исходных веществ и продуктов реакции.
1. Введем обозначения: [А], [В], [С], [D] – равновесные концентрации веществ, моль/л; [В]прореаг. – количество прореагировавшего вещества В, моль/л. к моменту равновесия прореагировало 50% вещества А, [А]=С0А×0,5=0,6×0,5=0,3.
2. Согласно уравнению реакции 2А+3В«3С+D вещество В прореагировало в 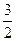 раза больше, чем А, т.е. [В]прореаг.= 0,3×1,5=0,45 моль/л, [В]=С0В-[В]прореаг.=1,0 – 0,45=0,55 моль/л.
раза больше, чем А, т.е. [В]прореаг.= 0,3×1,5=0,45 моль/л, [В]=С0В-[В]прореаг.=1,0 – 0,45=0,55 моль/л.
3. Исходя из сравнения коэффициентов, можно сделать вывод, что [С]=[В]прореаг.=0,45 моль/л, [D]= 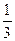 [С]=0,15 моль/л.
[С]=0,15 моль/л.
4. Составим выражение для константы равновесия системы 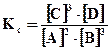 , после подстановки найденных численных значений получим
, после подстановки найденных численных значений получим
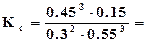 0,912.
0,912.
5. Уравнение реакции 2А+3В«3С+D показывает, что прямая реакция
протекает с образованием меньшего числа молей газа, т.е. с уменьшением давления. Обратная реакция протекает с образованием большего числа молей, т.е. с увеличением давления. При увеличении давления, согласно принципу Ле-Шателье, равновесие смещается в сторону образования меньшего числа молей газообразных веществ, т.е. в направлении прямой реакции.
Задачи к главе 4
Й уровень
161 – 165Восколько раз изменится скорость прямой гомогенной реакции, если концентрацию вещества А увеличить в X раз, а концентрацию вещества В уменьшить в Y раз
| Задачи | Реакция | X | Y |
| А+2В=С | |||
| 2А+В=С | |||
| 3А+2В=С | |||
| А+3В=С | |||
| А+В=С |
166-170. Температурный коэффициент скорости некоторой реакции равен g. Во сколько раз увеличится скорость этой реакции, если температуру повысить на Δt, 0С?
| Задачи | |||||
| g | 2,0 | 2,4 | 2,2 | 3,0 | 3,8 |
| Δt, 0С |
171-175. Равновесие в гомогенной газовой системе установилось в момент, когда прореагировало 50% вещества А. Вычислите константу равновесия, если концентрации исходных веществ равны СоА и СоВ. В какую сторону сместится равновесие при повышении давления?
| Задачи | Система | СоА,моль/л | СоВ, моль/л |
| 2А+2В=С+2D | 1,1 | 2,5 | |
| А+4В =2С+2D | 0,8 | 2,6 | |
| 3А+ В =С+3D | 1,2 | 0,8 | |
| 2А+3В=С+3D | 0,3 | 0,7 | |
| А +2В =2С+D | 1,0 | 1,6 |
Й уровень
176-180. Вгомогенной химической реакции установилось состояние равновесия с константой равновесия, равной k. Рассчитайте равновесные концентрации всех веществ, если начальная концентрация исходного вещества равна Со :
| Задачи | Реакция | k | Со, моль/л |
| 2HCl(г) =H2(г)+Cl2(г) | 0,5 | 0,20 | |
| 2NO(г)=O2(г)+N2(г) | 0,29 | 0,80 | |
| 2HBr(г)=H2(г)+Br2(г) | 0,36 | 0,10 | |
| PCl5(г)=PCl3(г)+Cl2(г) | 1,23 | 0,05 | |
| 2HI(г)=H2(г)+I2(г) | 0,65 | 0,20 |
181.Определите энергию активации реакции, константа скорости которой увеличилась в 105 раз при повышении температуры с 330 до 400 К.
182. Протекают две реакции. Энергия активации первой из них на 10 кДж меньше, чем у второй. Во сколько раз скорость первой реакции больше скорости второй при 100 и при 700 °С, если их предэкспоненциальные множители одинаковы?
183. Скорость реакции удваивается при увеличении температуры на 10 °С. При каком значении энергии активации это утверждается в интервале 295-305 °С?
184. Энергия активации разложения диоксида азота на оксид азота (II) и кислород равна 111 кДж/моль. Во сколько раз увеличится константа скорости реакции при повышении температуры с 330 до 400 К?
185. В сосуд объемом 0,5 л было помещено 0,5 моль Н2 и 0,5 моль N2. При некоторой температуре к моменту равновесия образовалось 0,02 моль NН3. Вычислите константу равновесия.
186-190. Определить константу скорости химической реакции при температуре Т и энергию активации, если при Т1 константа скорости реакции равна К1, а при температуре Т2 – К2.
| Задачи | T, °С | T 1, °С | T 2, °С | К1, с-1 | К2, с-1 |
| 1,08·10-4 | 5,48·10-4 | ||||
| 4,08·10-4 | 19,83·10-4 | ||||
| 5,1·10-5 | 4,76·10-4 | ||||
| 3,3·10-3 | 4,65·10-2 | ||||
| 8,47·10-3 | 9,41·10-2 |
191. Вычислить температуру, при которой константа равновесия реакции
2NO2 (г)↔N2O4(г) равна единице. Изменениями ΔΗº и ΔSºс температурой пренебречь. В каком направлении сместится равновесие при температуре более низкой, чем найденная?
192. Величина ΔGº для реакции А + В↔АВ при 298 К равна – 8 кДж/моль. Начальные концентрации веществ А и В равны 1 моль/л. Найти константу равновесия реакции и равновесные концентрации веществ А, В и АВ.
193. Металлы можно получит прямым восстановлением водородом, например, железо по реакции
FeO(к) + Н2 = Fe + Н2О(г)
Рассчитайте температуру, при которой установится равновесие? Рассчитайте равновесную концентрацию водорода и паров воды в системе, если начальная концентрация водорода была равна 5 моль/л.
194. Один из вредных компонентов выхлопных газов автомобиля – оксид углерода СО. Его можно нейтрализовать окислением: СО + ½ О2 = СО2.
Если в системе установится равновесие, то какие внешние воздействия будут способствовать нейтрализации СО?
195. Углекислота Н2СО3 способствует химическому разрушению (коррозии) металла. Она может быть удалена из воды путем разложения по реакции: Н2СО3(р) = СО2 + Н2О(ж) (ΔΗ>0). Если система находится в равновесии, то какие внешние воздействия будут способствовать разложению Н2СО3?
Й уровень
196. В водоем со сточными водами попал гербицид, начальная его концентрация в водоеме составила 10-4 моль/л. Определите период полупревращения гербицида при взаимодействии его с компонентами среды, и изменение его концентрации через 100 ч, если реакция имеет первый порядок, а константа скорости равна 10-6с-1.
197. Для удаления сероводорода из промышленных сточных вод предложена реакция его неполного окисления до серы и воды. Если концентрации О2 и Н2S равны 10-4 моль/л, а константа скорости составляет 10-4 моль·л·с-1, то каковы начальная скорость реакции и период полупревращения?
198. Константы скоростей прямой и обратной реакций при 298 К равны соответственно 10-5 и 10-9с-1. Рассчитайте стандартную энергию Гиббса реакции. В реакции первого порядка энергия активации Е = 104,5 кДж/моль и в уравнении Аррениуса предэкспоненциальный множитель А = 5·10-13с-1. При какой температуре период полупревращения сократится в 10 раз?
199. Период полураспада радиоактивного 11С равен 20,5 мин. Рассчитайте константу скорости. Сколько позитронов излучит 10-6 г изотопа 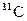 за время полураспада?
за время полураспада?
200.Скорость некоторой реакции изучали, измеряя объем V газообразного продукта, выделяющегося через различные промежутки времени t:
| V, см3 | 6,3 | 11,4 | 15,53 | 18,9 | 34,75 |
| t, с | ∞ |
Установить графически порядок реакции, рассчитать константу скорости k и период полупревращения.
201 – 205. Железный стержень погружен в Х –молярный раствор соляной кислоты. Через время t от начала реакции при постоянном перемешивании концентрация оказалась равной Y. Определить время, по истечении которого концентрация раствора станет равной Z. Какие предположения и допущения необходимо использовать при решении этой задачи?
| Задачи | Х, моль/л | t, мин | Y, моль/л | Z , моль/л |
| 0,01 | 1,0·10-4 | 1,0·10-3 | ||
| 0,02 | 2,5·10-4 | 5,0·10-3 | ||
| 0,16 | 3,0·10-4 | 3,0·10-3 | ||
| 0,03 | 7,8·10-4 | 2,7·10-3 | ||
| 0,10 | 1,0·10-3 | 1,0·10-2 |
РАСТВОРЫ.
Дата добавления: 2016-01-09; просмотров: 3094;
