Безразмерные характеристики материального баланса
Введем понятие основного реагента. Это реагент, который взят в недостатке, т.е. тот, у которого отношение начального количества вещества к положительному значению его стехиометрического коэффициента будет наименьшим 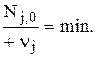
Степень превращения основного реагента А – это доля израсходованного реагента А, пошедшего на образование всех веществ:
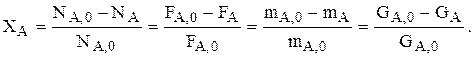 Если V=const, то
Если V=const, то 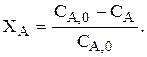
Степень превращения может меняться от 0 до 1 или от 0 до 100 %. Очевидно, что  NA=NA,0–NA,0×XA=NA,0×(1–XA) и, если V=const, то СA=СA,0×(1–XA).
NA=NA,0–NA,0×XA=NA,0×(1–XA) и, если V=const, то СA=СA,0×(1–XA).
Для простой реакции NA,0–NA=nА×h и NA,0–NA=NA,0×XA, т.е. nА×h= NA,0×XA и 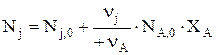 Здесь nА положительно, а nj имеет знак минус (–) для веществ расходующихся и плюс (+) для образующихся.
Здесь nА положительно, а nj имеет знак минус (–) для веществ расходующихся и плюс (+) для образующихся.
Для характеристики материального баланса многостадийных (сложных) реакций вводят безразмерную величину, называемую селективностью. Различают дифференциальную и интегральную селективности.
Интегральная селективность – это отношение количества реально полученного продукта j к его теоретическому количеству, которое могло бы образоваться из основного реагента А при отсутствии побочных реакций и потерь. Интегральную селективность для j по А записывают так:
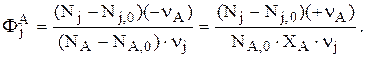
Например
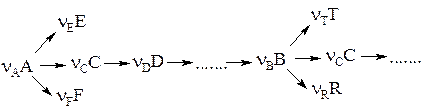
Тогда 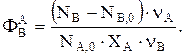
Если вещество j образуется из А по одной реакции, то 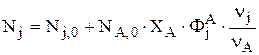 или
или 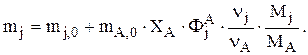
Такова связь между мольной и массовой интегральными селективностями. Аналогичные зависимости справедливы для мольных (F) и массовых (G) потоков. Если под j понимать В (целевой продукт), то уравнение используют для нахождения количества А на входе в реактор, например FА,0, при заданной производительности GВ
.
По определению интегральная мольная селективность вещества j по А имеет вид:
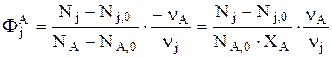 , откуда следует:
, откуда следует:
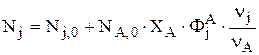 или
или
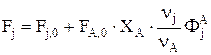
Если Fj задано и требуется определить FA,0, то можно записать
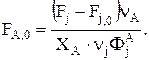
Соответственно, для массовых потоков имеем:
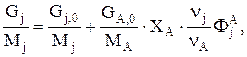 откуда
откуда
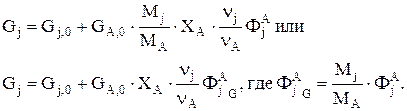
Селективность можно определить как отношение скорости целевой реакции (скорости образования целевого продукта) к общей скорости процесса (скорости расходования реагента). Рассчитанную таким образом селективность дифференциальной.
где rцел.р. – скорость расходования реагента по целевой реакции; rобщ. – суммарная скорость расходования реагента.
Пример. Учебник стр.28-30
Дата добавления: 2016-01-26; просмотров: 2596;
