W – м3/ время (общий объемный поток).
Материальный баланс
Стехиометрические соотношения
Для периодических процессов количество вещества jбудем обозначать так:
Nj – моль j (количество молей j);
mj – кг j (масса j).
Для непрерывных процессов потоки вещества j обозначим:
Fj – кмоль j/время (мольный поток j);
Gj – кг j/ время (массовый поток j);
W – м3/ время (общий объемный поток).
Связь между потоками
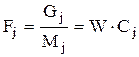 ,
,
где Сj – мольная концентрация j в потоке моль j/м3;
Mj – молекулярная масса j.
Рассмотрим стехиометрические соотношения для одностадийной реакции:
nАА + nYY ® nВВ + nZZ, где nj – стехиометрический коэффициент вещества j в данной реакции (схематично, если одна стрелка, две стрелки — две стадии и т.д.).
Тогда справедливо:
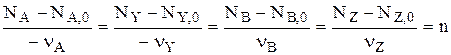 ,
,
где Nj,o – начальное количество вещества j;
Nj – его текущее количество (в любой момент времени t);
n – химическая переменная (глубина протекания реакции).
Аналогичные зависимости справедливы для проточных систем:
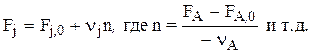
Теперь:
NA = NA,0 – nА·n
NВ = NA,0 + nВ·n
Nj = Nj,0 + nj·n
где nj берется со знаком минус (—) для веществ расходующихся, а плюс (+) для образующихся.
Если объем системы в результате реакции не меняется (V = const), то
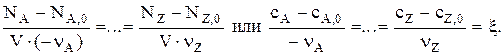
Тогда: СA = СA,0 – nА·x или Сj = Сj,0 + nj·x.
Если j участвует в Р реакциях, то
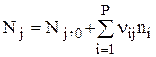 , где i — номер стадии, на которой участвует вещество j. Если на i-ой стадии вещество j образуется, то nij берется с плюсом; если расходуется, то с минусом. При V=const имеем:
, где i — номер стадии, на которой участвует вещество j. Если на i-ой стадии вещество j образуется, то nij берется с плюсом; если расходуется, то с минусом. При V=const имеем:
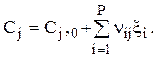
Пример
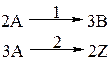
| Дано: СА,0, СВ,0 = СZ,0 = 0, СВ и СZ. Найти СА. |
Решение.
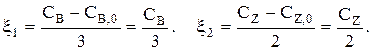
Теперь:

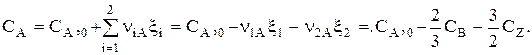
Запишем теперь скорость химической реакции для i-ой стадии:
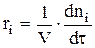 , где t — текущее время.
, где t — текущее время.
Если V=const, то 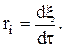
Скорость реакции по веществу j, участвующему на Р стадиях, запишется так:
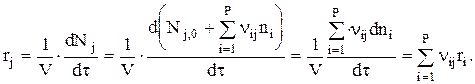
Необходимо отметить, что ri всегда положительна. Знак ri определяется знаком nij. Скорость ri положительна для веществ, образующихся на i-ой стадии, и отрицательна для веществ расходующихся.
Если V=const, то 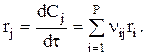
Пример
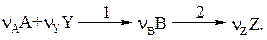 Это двухстадийная реакция. Соответственно,
Это двухстадийная реакция. Соответственно,
r1 и r2 –скорости 1 и 2 стадий. Считать (это дано), что по каждому реагенту (А, Y и В) реакция имеет первый (частный порядок); V=const.
Тогда: r1 = k1·CACY и r2 = k2·CВ. Здесь k1 и k2 –константы скоростей 1 и 2 стадий.
Найдем кинетическое описание процесса, т.е. изменение концентраций двух ключевых веществ, например, А и В. Очевидно, зная концентрации А и В в любой момент времени, можно найти концентрации Y и Z в этот же момент времени, используя стехиометрические соотношения материального баланса.
Решение.
Запишем rA=—nAr1 и rВ=nВr1—nВr2.
Тогда
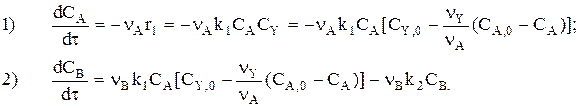
Система «1-2» решается совместно, и для любого t находим СА и СВ. Затем находят 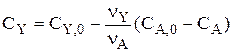 и
и 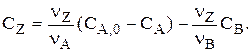
Пример.
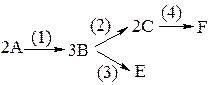
Требуется написать кинетическую схему.
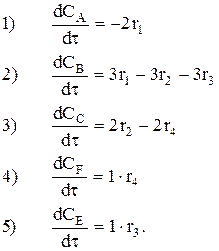
Дата добавления: 2016-01-26; просмотров: 2106;
