Электролиз и электролитическая проводимость
9.1 Электролиз
Электролизом называется явление выделения на электродах составных частей электролита при прохождении через электролит электрического тока.
На рисунке 9.1 представлена обобщённая картина протекания явления электролиза, характеризующая наиболее общие подходы к пониманию данного явления.

Рисунок 9.1 – Обобщённая картина протекания электролиза
Химические реакции, в которые вступают нейтрализовавшиеся ионы (катионы или анионы) являются вторичными химическими реакциями. Данные химические реакции могут происходить, а могут и не происходить.
Примером химической реакции, исключающей вторичные химические реакции, может служить химическая реакция вида
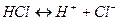 . (9.1)
. (9.1)
После анода ионы хлора отдают свои избыточные электроны. Получается молекула хлора
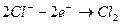 . (9.2)
. (9.2)
На катоде нейтрализуются атомы водорода
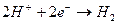 . (9.3)
. (9.3)
Вторичной химической реакции при этом не происходит. Растворённая соляная кислота 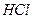 расходуется, а на электродах выделяются хлор
расходуется, а на электродах выделяются хлор 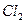 и водород
и водород 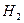 .
.
Примером химической реакции с наличием вторичной химической реакции служит химическая реакция вида (9.4):
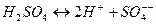 . (9.4)
. (9.4)
Два «минуса» в выражении (9.4) обозначают наличие двухзарядного отрицательного иона. В ходе электролиза:
- на катоде нейтрализуются атомы водорода (9.3);
- на аноде получается химически активное вещество вида
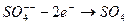 , (9.5)
, (9.5)
которое вступает в химическую реакцию с водой. Получается
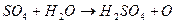 . (9.6)
. (9.6)
Таким образом, вторичная химическая реакция происходит непосредственно с растворителем.
9.2 Законы Фарадея
Первый закон Фарадея формулируется следующим образом. Масса выделившегося на электроде вещества пропорционально заряду, прошедшему через электролит
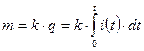 . (9.7)
. (9.7)
В выражении (9.7):
- 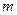 – масса выделившегося вещества;
– масса выделившегося вещества;
- 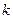 – коэффициент пропорциональности, который зависит от природы вещества, и носит название электрохимического эквивалента вещества, т.е. массы вещества, выделившейся на электроде при прохождении через электролит единичного заряда;
– коэффициент пропорциональности, который зависит от природы вещества, и носит название электрохимического эквивалента вещества, т.е. массы вещества, выделившейся на электроде при прохождении через электролит единичного заряда;
- 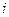 – сила тока.
– сила тока.
Второй закон Фарадея говорит о следующем. Электрохимические эквиваленты всех веществ пропорциональны их химическим эквивалентам.
Выражение для химического эквивалента вещества имеет вид 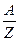 , где
, где 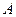 – это атомный вес вещества,
– это атомный вес вещества, 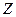 – валентность. Другими словами, химическим эквивалентом вещества является масса вещества, которое в ходе протекания химической реакции замещает
– валентность. Другими словами, химическим эквивалентом вещества является масса вещества, которое в ходе протекания химической реакции замещает 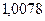 грамм водорода. Валентностью
грамм водорода. Валентностью 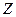 называется количество атомов водорода, которое замещается в химических соединениях одним атомом вещества.
называется количество атомов водорода, которое замещается в химических соединениях одним атомом вещества.
Связь между электрохимическим и химическим эквивалентами вещества имеет вид
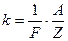 , (9.8)
, (9.8)
где 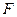 – число Фарадея, а
– число Фарадея, а 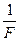 – коэффициент, связывающий электрохимический и химический эквиваленты вещества.
– коэффициент, связывающий электрохимический и химический эквиваленты вещества.
Подставляя (9.8) в (9.7), получим ещё одно выражение для первого закона Фарадея:
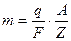 . (9.9)
. (9.9)
Таким образом, при условии 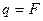 масса выделившегося на электроде вещества равна химическому эквиваленту данного вещества, т.е.
масса выделившегося на электроде вещества равна химическому эквиваленту данного вещества, т.е. 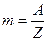 . Другими словами, для выделения на электроде единицы массы любого эквивалента вещества, нужно пропустить через электролит одно и тоже количество электричества, равного
. Другими словами, для выделения на электроде единицы массы любого эквивалента вещества, нужно пропустить через электролит одно и тоже количество электричества, равного 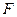 .
.
Опытным путём установлено, что число Фарадея 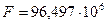 [
[ 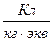 ] или
] или 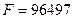 [
[ 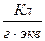 ]. Килограмм-эквивалент любого вещества содержит
]. Килограмм-эквивалент любого вещества содержит 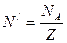 атомов, следовательно
атомов, следовательно 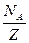 ионов переносят заряд равный
ионов переносят заряд равный 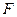 .
.
На долю каждого иона приходится следующее значение величины заряда:
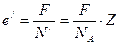 . (9.10)
. (9.10)
Таким образом, заряд иона равный 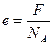 соответствует элементарному заряду.
соответствует элементарному заряду.
9.3 Электролитическая проводимость
Каждому значению величины электрического поля 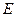 соответствует своё значение скорости установившегося равномерного движения ионов
соответствует своё значение скорости установившегося равномерного движения ионов
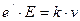 . (9.11)
. (9.11)
В выражении (9.11):
- 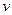 – скорость движения ионов;
– скорость движения ионов;
- 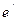 – заряд иона;
– заряд иона;
- 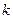 – коэффициент пропорциональности между скоростью иона и силой сопротивления среды.
– коэффициент пропорциональности между скоростью иона и силой сопротивления среды.
Таким образом, значение скорости установившегося равномерного движения ионов определяется выражением
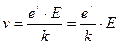 . (9.12)
. (9.12)
В выражении (9.12) величина, равная отношению 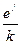 носит название подвижности ионов
носит название подвижности ионов 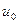 . Ионы разных знаков обладают различной подвижностью. Подвижность ионов в электролитах очень мала и имеет приблизительное значение
. Ионы разных знаков обладают различной подвижностью. Подвижность ионов в электролитах очень мала и имеет приблизительное значение 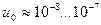 [
[  ].
].
Движение ионов создаёт электрический ток, плотность которого равна
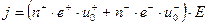 , (9.13)
, (9.13)
где:
- 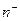 (
( 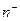 ) – количество положительных (отрицательных) ионов в единице объёма вещества;
) – количество положительных (отрицательных) ионов в единице объёма вещества;
- 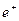 (
( 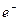 ) – величины положительных (отрицательных) зарядов ионов;
) – величины положительных (отрицательных) зарядов ионов;
- 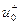 (
( 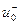 ) – подвижности положительных (отрицательных) ионов.
) – подвижности положительных (отрицательных) ионов.
Если молекулы диссоциируют на два иона, т.е. 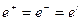 ,
, 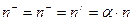 , тогда
, тогда
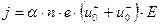 . (9.14)
. (9.14)
Проводимость электролита определяется выражением
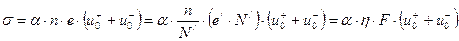 . (9.15)
. (9.15)
В выражении (9.15) символ 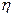 обозначает концентрацию ионов в килограмм-эквиваленте электролита.
обозначает концентрацию ионов в килограмм-эквиваленте электролита.
При увеличении температуры коэффициент диссоциации 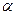 и подвижность ионов
и подвижность ионов 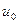 увеличиваются. Следовательно, увеличивается значение величины проводимости
увеличиваются. Следовательно, увеличивается значение величины проводимости 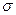 .
.
Дата добавления: 2016-02-04; просмотров: 1371;
