Изменение агрегатного состояния вещества
4.1 Испарение и конденсация
В жидкости и твёрдом теле при любой температуре есть молекулы, энергии у которых достаточно для преодоления притяжения к другим однородным молекулам и покинуть поверхность жидкости или твёрдого тела и перейти в газообразное состояние (фазу). Переход жидкости в газообразное состояние называется испарением. Переход твёрдого тела в газообразное состояние называется сублимацией.
Удельной теплотой испарения (газообразования) или сублимации – это тепло 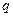 , которое нужно сообщить единице массы вещества, чтобы превратить его в пар, имеющий такую же температуру
, которое нужно сообщить единице массы вещества, чтобы превратить его в пар, имеющий такую же температуру 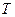 .
.
Процесс перехода, обратный испарению или сублимации носит название конденсация.
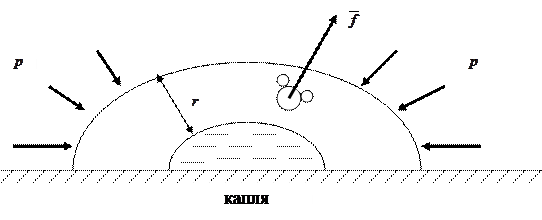 При испарении жидкости её молекулы должны совершить работу против сил, действующих в поверхностном слое. Средняя сила
При испарении жидкости её молекулы должны совершить работу против сил, действующих в поверхностном слое. Средняя сила 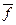 в жидкости определённой массы, имеющей количество молекул
в жидкости определённой массы, имеющей количество молекул 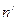 , преодолевающих противодействие на пути толщиной
, преодолевающих противодействие на пути толщиной 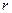 , совершает работу (рисунок 4.1), равную
, совершает работу (рисунок 4.1), равную 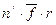 .
.
Рисунок 4.1 – Процесс противодействия внешним силам, действующим извне на каплю вещества
Кроме того, испарение предполагает противодействие внешним силам (давлению), действующим извне на вещество. Работа по преодолению внешних сил определяется выражением вида 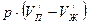 , где
, где 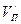 и
и 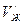 – удельные объёмы жидкости и пара. Обе работы совершаются за счёт теплоты испарения
– удельные объёмы жидкости и пара. Обе работы совершаются за счёт теплоты испарения 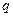 :
:
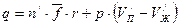 . (4.1)
. (4.1)
Рассмотрим процесс установления равновесия между жидкостью и паром. Возьмём герметичный сосуд, частично наполненный жидкостью, и откачаем из него воздух. Пространство между жидкостью и сосудом за счёт испарения начнёт заполняться молекулами жидкости, причём одна часть молекул будет возвращаться обратно в жидкость, другая часть молекул в жидкость возвращаться не будет. Рано или поздно (рисунок 4.2), количество молекул первой и второй группы станут равными. Таким образом, давление, при котором устанавливается подвижное равновесие между жидкостью и паром (давление насыщенного пара), оказывается зависящим от температуры (рисунок 4.3).
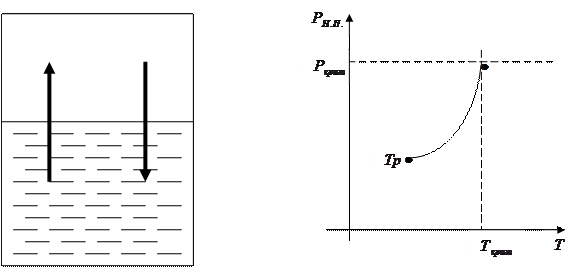 |
Рисунок 4.2 – Установление подвиж- Рисунок 4.3 – График зависи-
ного равновесия между мости давления
жидкостью и паром от температуры
На рисунке 4.3:
- 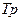 – тройная точка;
– тройная точка;
- 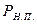 – давление насыщенного пара;
– давление насыщенного пара;
- 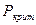 – критическое давление пара – давление пара при критической температуре
– критическое давление пара – давление пара при критической температуре 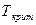 .
.
Для системы «твёрдое тело – газ» всё сказанное также справедливо.
4.2 Плавление и кристаллизация
Переход кристаллического тела в жидкое состояние происходит при определённой для каждого вещества температуре 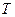 и требует затрат некоторого количества тепла, называемого теплотой плавления. Процесс плавления вещества представлен на графике (рисунок 4.4). Сначала температура тела увеличивается. При достижении значения температуры плавления
и требует затрат некоторого количества тепла, называемого теплотой плавления. Процесс плавления вещества представлен на графике (рисунок 4.4). Сначала температура тела увеличивается. При достижении значения температуры плавления 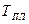 (точка 1) несмотря на то, что в единицу времени подаётся определённое количество тепла (одинаковое), температура тела сохраняется постоянной, т.е.
(точка 1) несмотря на то, что в единицу времени подаётся определённое количество тепла (одинаковое), температура тела сохраняется постоянной, т.е. 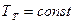 . Одновременно начинается процесс плавления твёрдого тела. По окончании процесса плавления всё вещество переёдёт в жидкое состояние (точка 2), а температура тела снова начнёт повышаться.
. Одновременно начинается процесс плавления твёрдого тела. По окончании процесса плавления всё вещество переёдёт в жидкое состояние (точка 2), а температура тела снова начнёт повышаться.
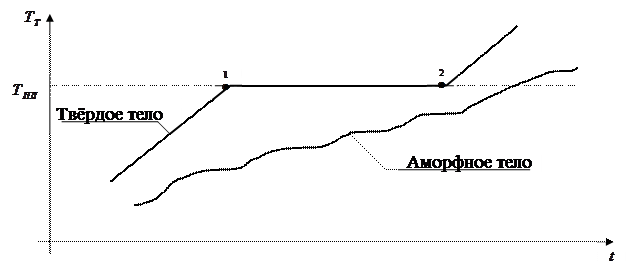 |
Рисунок 4.4 – График изменения температуры во времени при нагревании тела
При нагревании аморфного тела его температура непрерывно растёт. Для таких тел нет определённой температуры перехода в жидкое состояние, поскольку аморфные тела – это сильно переохлаждённые жидкости.
Температура плавления зависит от давления, т.е. 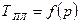 . Совокупности величин давления
. Совокупности величин давления 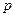 и температуры
и температуры 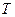 соответствует кривая плавления (рисунок 4.5).
соответствует кривая плавления (рисунок 4.5).
 |
Рисунок 4.5 – Кривая плавления льда Рисунок 4.6 – Диаграмма плавления льда
Все точки кривой плавления определяют условия, при которых кристаллическая и жидкая фазы могут находиться в равновесии друг с другом, поэтому каждой точке кривой плавления соответствует свой отрезок диаграммы плавления, как показано на рисунке 4.6, где 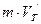 и
и 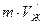 – соответственно твердотельный и жидкий удельные объёмы вещества.
– соответственно твердотельный и жидкий удельные объёмы вещества.
Кристаллизация – процесс, обратный процессу плавления.
При понижении температуры жидкости до уровня, когда в равновесии находятся твёрдая и жидкая фазы при заданном давлении, начинается рост количества кристаллов вокруг центров кристаллизации – взвешенных в жидкости частиц твёрдого тела. Если жидкость очистить от таких частиц, то её можно охладить до температуры, ниже температуры плавления ( 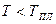 ). В этом случае состояние жидкости называется метастабильным. Жидкость в таком состоянии является малотекучей и представляет собой аморфное тело.
). В этом случае состояние жидкости называется метастабильным. Жидкость в таком состоянии является малотекучей и представляет собой аморфное тело.
В процессе кристаллизации выделяется столько же тепла, сколько расходуется при плавлении.
4.3 Уравнение Клайперона – Клаузиуса
Две любые фазы вещества могут находиться в равновесии только при определённых величинах давления и температуры. Общий вид этой зависимости можно получить с помощью второго начала термодинамики. Для этого рассмотрим цикл Карно для системы, состоящей из двух фаз вещества, находящихся в равновесии, как показано на рисунке 4.7:
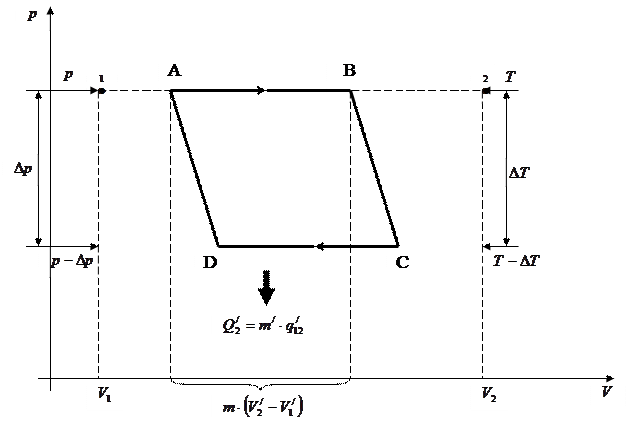 |
Рисунок 4.7 – Диаграмма цикла Карно для системы из двух фаз вещества
Участок «1 – 2» является горизонтальным участком изотермы с 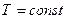 . Состояния «1» и «2» – однофазные состояния. Все промежуточные точки участка «1 – 2» – двухфазные состояния, отличающиеся друг от друга распределением массы вещества между первой и второй фазами. Изотермический процесс «А
. Состояния «1» и «2» – однофазные состояния. Все промежуточные точки участка «1 – 2» – двухфазные состояния, отличающиеся друг от друга распределением массы вещества между первой и второй фазами. Изотермический процесс «А 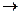 В» сопровождается фазовым превращением некоторой массы вещества
В» сопровождается фазовым превращением некоторой массы вещества 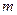 . При этом объём вещества получает приращение вида
. При этом объём вещества получает приращение вида
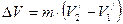 , (4.2)
, (4.2)
где 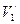 и
и 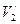 – удельные объёмы первой и второй фаз вещества.
– удельные объёмы первой и второй фаз вещества.
Для того чтобы произошёл переход, необходимо системе сообщить некоторое количество тепла 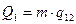 . Тепло отдаётся холодильнику в ходе изотермического процесса «С
. Тепло отдаётся холодильнику в ходе изотермического процесса «С  D».
D».
Работа, совершаемая за цикл, равна
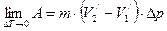 . (4.3)
. (4.3)
КПД цикла определяется по формуле:
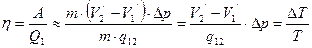 . (4.4)
. (4.4)
Поэтому справедливо соотношение:
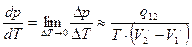 . (4.5)
. (4.5)
Уравнение (4.5) получило название уравнение Клайперона – Клаузиуса.
4.4 Тройная точка. Диаграмма состояния
Если взять жидкость и находящийся с ней в равновесии насыщенный пар, потом, не изменяя объёма, пытаться охладить эту систему, то процесс будет сопровождаться понижением температуры и давления. Точка по кривой испарения будет перемещаться вниз до достижения температуры кристаллизации. Пусть эта температура равна 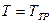 . В процессе кристаллизации давление и температура будут оставаться постоянными. Отводимое при этом тепло – это тепло, выделяемое при кристаллизации.
. В процессе кристаллизации давление и температура будут оставаться постоянными. Отводимое при этом тепло – это тепло, выделяемое при кристаллизации.
Как показано на рисунке 4.8 температуре 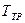 соответствует величина давления
соответствует величина давления 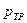 . Данным значениям соответствует возможность нахождения в равновесном состоянии три фазы вещества: твёрдая, жидкая и газообразная.
. Данным значениям соответствует возможность нахождения в равновесном состоянии три фазы вещества: твёрдая, жидкая и газообразная.
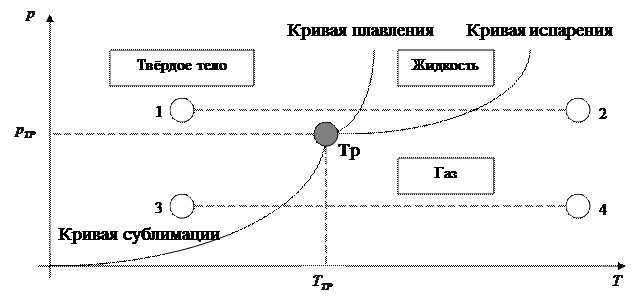 |
Рисунок 4.8 – Диаграмма состояния вещества
Точка «Тр» на диаграмме является тройной точкой. Эта точка определяет условия, при которых могут находиться в равновесии одновременно три фазы вещества. Тройная точка – это точка пересечения трёх кривых:
- кривой равновесия твёрдой и жидкой фазы – кривой плавления;
- кривой равновесия твёрдой и газообразной фазы – кривой сублимации;
- кривой равновесия жидкой и газообразной фазы – кривой испарения.
График функции 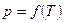 , изображённый на рисунке 4.8, носит название диаграмма состояния.
, изображённый на рисунке 4.8, носит название диаграмма состояния.
Пусть вещество находится в состоянии «1». Для его перехода в состояние «2» веществу нужно пройти состояние «твёрдое тело» – «жидкость» – «газ». Если вещество находится в состоянии «3», то оно может перейти в состояние «4», минуя жидкое состояние.
Как следует из диаграммы, вещество может находиться в жидком состоянии только при условии 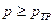 . Иначе, если
. Иначе, если 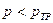 , то при таком условии жидкость может существовать только в переохлаждённом виде.
, то при таком условии жидкость может существовать только в переохлаждённом виде.
Дата добавления: 2016-02-04; просмотров: 1372;
