Химические свойства. По своим химическим свойствам алкины похожи на алкены
По своим химическим свойствам алкины похожи на алкены. Для них также наиболее характерными являются реакции электрофильного присоединения. Для несимметричных алкинов, как и для алкенов, действует правило Марковникова. Существенным отличием является меньшая реакционная способность тройных связей по сравнению с двойными. Поскольку в результате присоединения образуется замещенный алкен (с более реакционноспособной связью), то при избытке присоединяющегося реагента реакция, как правило, идет дальше и образуется замещенный алкан:
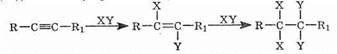
Кроме того, наличие кислотного характера связи С-Н в терминальных алкинах приводит к появлению совершенно нового вида реакций, нехарактерного для алкенов.
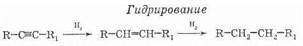
Используя специальные катализаторы, можно остановить реакцию на стадии алкена (даже при избытке водорода).
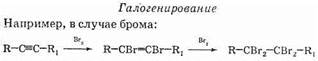
Отсюда видно, что качественная реакция с бромной водой не позволяет отличить алкены от алкинов.
Гидрогалогенирование
Как уже говорилось, реакционная способность тройной связи ниже, чем двойной. Из-за этого галогеноводороды присоединяются к тройной связи только при наличии катализатора. В качестве катализатора используются кислоты Льюиса, обычно соответствующий галогеноводороду галогенид алюминия. Так, для присоединения хлороводорода используется хлорид алюминия:
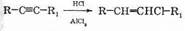
Для несимметричных алкинов работает правило Марковникова.
Гидратация
Для гидратации алкинов также необходим катализатор. Им является сочетание солей двухвалентной ртути и кислой среды. Реакция гидратации алкинов с использованием этого катализатора называется реакцией Кучерова:
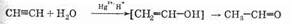
На первой стадии, как и следовало ожидать, образуется спирт, причем его гидроксильная группа связана с двойной связью. Такие спирты называются енолами. Енолы в свободном виде крайне нестабильны (это отражено в уравнении реакции квадратными скобками) и сразу изомеризуются, как это написано, в соответствующие альдегиды или кетоны. При изомеризации происходит перенос протона с гидроксида на атом углерода, а p-связь перемещается к атому кислорода. Движущей силой этой реакции является большая стабильность двойной связи углерод-кислород
| По сравнению со связью углерод-углерод.
Следует отметить, что в реакции Кучерова альдегид образуется только в случае ацетилена. Из всех остальных алкинов (в том числе и терминальных) образуются кетоны (поскольку первая
стадия процесса — электрофильное присоединение — подчиняется правилу Марковникова):
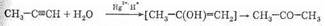
Окисление
Как и алкены, алкины легко окисляются (в частности, пер. манганатом калия). Однако при этом обычно сразу образуются продукты с расщепленной С-С связью:
R-OºC-R'+[О]+Н2O®R-COOH+R'-COOH
Однако внешние признаки реакции (обесцвечивание перманганата и появление коричневого осадка диоксида марганца) такие же, как для алкенов, и, значит, эта реакция также не пригодна для качественного различения алкенов и алкинов.
Алкины, конечно, сгорают на воздухе или в кислороде, образуя углекислый газ и воду.
Полимеризация
Алкины, как и алкены, способны полимеризоваться. В зависимости от условий получаются самые разнообразные продукты. Однако очень важным является тримеризация ацетилена в бензол при 100°С. Катализатором этой реакции является активированный уголь:
3НCºСН®С6Н6
Эта реакция важна, поскольку позволяет получить ароматические соединения из неорганических (через стадию карбида кальция).
Кислотные свойства
Как мы уже говорили, в терминальных алкинах (с тройной связью на конце цепи) концевой атом водорода проявляет слабокислотные свойства. Соответственно такие алкины могут вступать в реакции с сильными основаниями и образовывать соли — ацетилениды:
R-CºC-H+NaNH2®R-СºC-Na++NH3
Несколько иного типа реакция происходит между терминальными алкинами и аммиачными растворами оксида серебра или хлорида меди(I):
R-CºC-H + [Ag(NH3)2]+ОН-®R-CºC-Ag¯+2NH3+H2O R-CºC-H+2[Cu(NH3)2]+OH-®R-CºC-Cu¯ + 4NH3+2H2O
Образование осадка при реакции с одним из этих растворов может служить для качественного определения алкинов (особенно когда их нужно отличить от алкенов).
Хотя эти реакции также связаны с кислотностью алкинов, получающиеся соединения не являются, строго говоря, солями — характер связи C-Ag или С-Cu в значительной степени ковалент-
Вый. Однако при реакции с сильными кислотами эти соединения ведут себя как соли слабой кислоты:
R-CºC-Ag+HCl®R-CºCH+AgCl
Ионные ацетилениды (щелочных и щелочноземельных металлов) легко разлагаются даже водой и не могут быть получены реакцией с обычными щелочами.
Реакции образования-разложения ацетиленидов меди или серебра могут служить для выделения алкинов из сложных смесей.
Способы получения
Имеющий важнейшее промышленное значение ацетилен получают в настоящее время частичным термическим разложением метана:
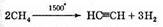
При этом важную роль играет практически мгновенное охлаждение продуктов — иначе процесс пойдет дальше и получатся углерод и водород.
Ранее в промышленности (а сейчас в полевых условиях и в лаборатории) ацетилен получается действием воды на карбид кальция (который, по сути дела, представляет собой ацетиленид кальция):
СаС2+2Н2О=Са(ОН)2+C2H2
Общим методом получения алкинов в лаборатории является дегидрогалогенирование дигалогеналканов:

При этом атомы галогена должны располагаться при одном атоме углерода. Получение алкина возможно также из виц-дигалогенида (атомы галогена расположены при соседних атомах углерода), если структура молекулы исключает возможность образования сопряженного диена (иначе получится именно он!).
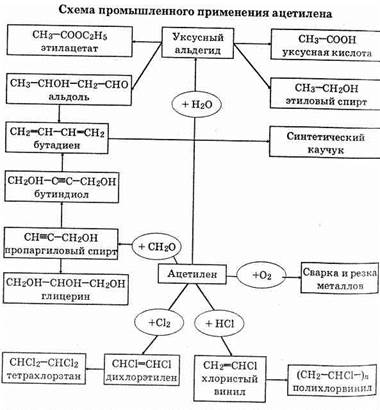
Применение
Ранее (а иногда и сейчас) ацетилен широко применялся для создания высокотемпературного пламени при газовой сварке. Сейчас на первый план вышло его применение для целей органического синтеза.
1. Получение растворителей. При присоединении хлора к ацетилену получается тетрахлорэтан:
СНºСН+2Сl2 ®СНСl2-СНСl2
а отщеплением от последнего молекулы хлороводорода — 1,1,2-трихлорэтен:
СНСl2-СНСl2®СНСl=ССl2+НСl
Оба этих вещества являются весьма ценными и широко применяемыми растворителями.
2. Полимеры. Из ацетилена получают, в частности, поливинил-хлорид следующими двумя реакциями:
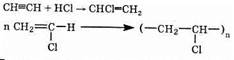
Поливинилхлорид очень широко применяется в промышленности и в быту. Более сложными схемами из ацетилена получают и другие мономеры.
Дата добавления: 2016-01-03; просмотров: 4256;
