Химические свойства. Все специфические химические свойства алкенов определяются наличием в их молекуле p-электронного облака (то есть собственно двойной связью)
Все специфические химические свойства алкенов определяются наличием в их молекуле p-электронного облака (то есть собственно двойной связью). Электроны p-облака находятся вне плоскости молекулы и легко доступны для атаки электрофильными частицами. Поэтому практически все реакции алкенов имеют электрофильный механизм (обычно это электрофильное присоединение, которое обозначается кратко как АЕ).
Галогенирование
Молекулы галогенов в среднем неполярны, однако возможны временные флуктуации, которые приводят к появлению электрофильности у такой молекулы:
Br—Br«Br+d—Br-d
и становится возможной реакция, механизм которой приведен ниже:

В результате реакции исчезает двойная связь и образуется дигалоген алкан. Реакция галогенирования (обычно бромирования) используется как качественная на двойную связь, поскольку в ходе реакции исчезает бурая окраска брома.
Гидрогалогенирование
Молекулы галогеноводородов изначально полярны, то есть имеют электрофильный центр (атом водорода несет частичный положительный заряд). Соответственно, такие молекулы тоже могут присоединяться к двойной связи:
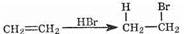
В случае алкенов несимметричного строения, однако, возможны варианты присоединения. Так, из пропена при действия бромоводорода могут получиться два продукта:
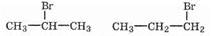
Для того, чтобы выяснить, какой продукт получается, необходимо учесть несимметричность в такой молекуле p-электронного облака, вызванную влиянием заместителя. Направление влияния определяется электроотрицательностью заместителя. Эффект влияния называется соответственно +I-эффектом и -I-эффектом:
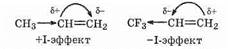
Понятно, что электрофил будет взаимодействовать с более отрицательным концом двойной связи. Так, для приведенных выше соединений результат реакции с бромоводородом будет разным:
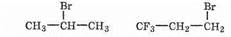
При присоединении галогеноводородов (или иных молекул типа НГ, например воды Н2О) к несимметричным алкенам водород присоединяется к электрон-обогащенному концу двойной связи.
Это современная формулировка правила Марковникова, которое в оригинале относится только к углеводородам (не имеющим никаких заместителей, кроме алкильных радикалов!) и звучит:

Гидратация
Присоединение воды к алкенам принципиально ничем не отличается от присоединения галогеноводородов (см. выше) и также подчиняется правилу Марковникова. Единственным отличием, связанным с меньшей полярностью воды, является необходимость катализа минеральными кислотами (серной, фосфорной и т.д.), которые обеспечивают высокую концентрацию протонов, которые являются собственно реагирующими частицами:
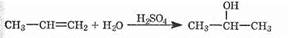
Окисление
В алкенах p-связь также легко подвержена действию окислителей. Это тоже электрофильные реакции, но рассмотрение их механизмов выходит за рамки данного курса. Важнейшей из таких реакций является реакция с перманганатом калия при низкой температуре в слабощелочной или нейтральной среде:
3СН2=СН2+2KMnO4+4Н2O=3СН2ОН—СН2ОН+2MnO2+2KOH Эта реакция называется реакцией гидроксилирования и также используется как качественная на алкены — в ходе реакции исчезает характерная фиолетовая окраска перманганата и образуется бурый осадок диоксида марганца. В более жестких условиях (кислая среда, высокая температура) возможно более глубокое окисление, вплоть до полного разрыва связи С—С:
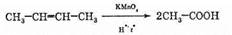
Следует отметить, что для простоты записи в органической химии при обозначении процессов окисления (или восстановления) часто используются символы [О] (или [Н]):
СН3—СН=СН—СН3®[O]2СН3—СООН
Однако если возможны варианты продуктов окисления (или восстановления), необходимо указание всех условий реакции (реагент, среда, температура).
Исчерпывающее окисление
Алкены (как и алканы) на воздухе или в кислороде сгорают до углекислого газа и воды: С2Н4+3O2=2СO2+2Н2O
Восстановление (гидрирование)
Взаимодействие алкенов с водородом происходит в присутствии металлических катализаторов (Ni, Pd, Pt и др.) при нагревании:
СН3—СН=СН2+Н2®СН3—СН2—СН3
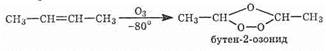
Озонирование
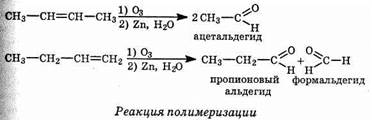
Большинство алкенов даже при низких температурах реагируют с озоном: разрывается двойная связь и образуются циклические перекисные производные, известные под названием озонидов.
Озониды, подобно большинству соединений, содержащих перекисные (О—О)-связи, могут взрываться с большой силой и совершенно неожиданно. Озонирование вследствие этого необходимо проводить с осторожностью. Озониды обычно не выделяют в чистом виде, а разлагают, гидролизуя водой и восстанавливая цинком; при этом образуются карбонильные соединения, которые, как правило, удается выделить и идентифицировать.
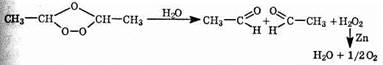
Эта последовательность реакций предоставляет отличную возможность установления положения двойных связей в алкенах. Применимость этого метода может быть проиллюстрирована на примере различных продуктов реакции в случае бутена-1 и бутена-2.
Рассмотрим реакцию на примере получения полиэтилена из молекул этилена.
Полимеризация — это последовательное соединение одинаковых молекул в более крупные.
Реакции полимеризации особенно характерны для непредельных соединений. Так, например, из этилена образуется высокомолекулярное вещество — полиэтилен. Соединение молекул этилена происходит по месту разрыва двойной связи:
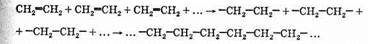
Сокращенно уравнение этой реакции записывается так: nСН2=СН2®(—СН2—СН2—)n
К концам этих молекул (макромолекул) присоединяются какие-нибудь свободные атомы или радикалы (например, атомы водорода). Продукт реакции полимеризации называется полимером (от греческого поли — много, мерос — часть), а молекулы
исходного вещества, вступающего в реакцию полимеризации, называются мономером.
Полимер — вещество с очень высокой молекулярной массой, молекула которого состоит из большого числа повторяющихся группировок, имеющих одинаковое строение. Эти группировки называют элементарными звеньями, или структурными единицами. Например, элементарным звеном полиэтилена является группировка атомов —СН2—СН2—.
Число элементарных звеньев, повторяющихся в макромолекуле, называется степенью полимеризации (обозначается n). В зависимости от степени полимеризации из одних и тех же мономеров можно получать вещества с различными свойствами. Так, полиэтилен с короткими цепями (га = 20) является жидкостью, обладающей смазочными свойствами. Полиэтилен с длиной цепи в 1500-2000 звеньев представляет собой твердый, но гибкий пластический материал, из которого можно получать пленки, изготавливать бутылки и другую посуду, эластичные трубы и т.д. Наконец, полиэтилен с длиной цепи в 5-6 тыс. звеньев является твердым веществом, из которого можно готовить литые изделия, жесткие трубы, прочные нити.
Если в реакции полимеризации принимает участие небольшое число молекул, то образуются низкомолекулярные вещества, например димеры, тримеры и т.д. Условия протекания реакций полимеризации весьма различные. В некоторых случаях необходимы катализаторы и высокое давление. Но главным фактором является строение молекулы мономера. В реакцию полимеризации вступают непредельные (ненасыщенные) соединения за счет разрыва кратных связей.
Структурные формулы полимеров кратко записываются так: формулу элементарного звена заключают в скобки и справа внизу ставят букву п. Например, структурная формула полиэтилена
(—СН2—СН2—)n. Легко заключить, что название полимера слагается из названия мономера и приставки поли-, например, полиэтилен, поливинилхлорид, полистирол и т.д.
С помощью реакций полимеризации получают высокомолекулярные синтетические вещества, например полиэтилен, политетрафторэтилен (тефлон), полистирол, синтетические каучуки и др. Они имеют огромное народнохозяйственное значение.
Поливинилхлорид — продукт полимеризации хлористого винила (винилхлорида) СН2=СНСl. Структурная формула
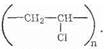
Этот полимер обладает ценными свойствами:
он негорюч, устойчив к действию химических реагентов, легко окрашивается. Из пластмасс на его основе изготавливают клеенки, плащи, портфели, искусственную кожу для обуви и т.п. Широко применяется для изоляции проводов и кабелей.
Тефлон — продукт полимеризации тетрафторэтилена: nCF2=CF2 ®(—CF2—CF2—)n.
Это самое инертное органическое вещество (на него оказывают воздействие только расплавленные калий и натрий). Обладает высокой морозо- и теплоустойчивостью.
Полистирол — твердое прозрачное упругое вещество. Получается полимеризацией стирола. Структурная формула
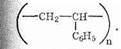
Полистирол широко используется в качестве
диэлектрика в электро- и радиотехнике. Идет на изготовление кислотоупорных труб, тары, а также бытовых изделий — расчесок, игрушек и др. Из него готовят легкие пористые пластмассы — пенопласты.
Наряду с реакциями полимеризации для получения высокомолекулярных соединений широко используются реакции поликонденсации.
Дата добавления: 2016-01-03; просмотров: 1136;
