Химические свойства. Физические свойства алканов
Физические свойства алканов
В обычных условиях первые четыре члена гомологического ряда алканов (С1 — С4) — газы. Нормальные алканы от пентана до гептадекана (С5 — С17) — жидкости, начиная с С18 и выше — твердые вещества. По мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов.
При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы.
Алканы практически нерастворимы в воде, т.к. их молекулы малополярны и не взаимодействуют с молекулами воды. Жидкие алканы легко смешиваются друг с другом. Они хорошо растворяются в неполярных органических растворителях, таких, как бензол, тетрахлорметан и т.п.
Строение
Молекула простейшего алкана — метана — имеет форму правильного тетраэдра, в центре которого находится атом углерода, а в вершинах — атомы водорода. Углы между осями связей С—Н составляют 109°28' (рис. 29).
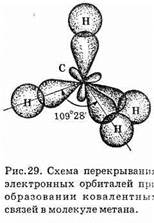
В молекулах других предельных углеводородов углы между связями (как С—Н, так и С—С) имеют такое же значение. Для описания формы молекул используется понятие гибридизации атомных орбиталей (см. часть I, §6).
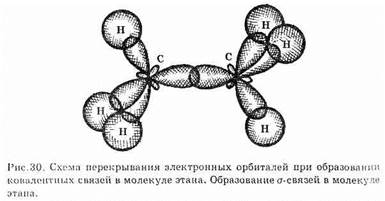
В алканах все атомы углерода находятся в состоянии sp3-гибридизации (рис. 30).
Таким образом, атомы углерода в углеродной цепи не находятся на одной прямой. Расстояние между соседними атомами углерода (между ядрами атомов) строго фиксировано — это длина химической связи (0,154 нм). Расстояние С1 — С3, С2 — С4 и т.д. (через один атом) тоже постоянны, т.к. постоянен угол между связями —валентный угол.
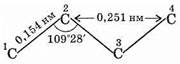
Расстояния между более удаленными атомами углерода могут изменяться (в некоторых пределах) в результате вращения вокруг s-связей. Такое вращение не нарушает перекрывания орбиталей, образующих s-связь, поскольку эта связь имеет осевую симметрию.
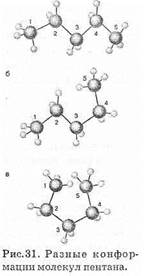
Разные пространственные формы одной молекулы, образующиеся при вращении групп атомов вокруг s-связей, называют конформациями (рис. 31).
Конформации различают по энергии, но это различие невелико (12-15 кДж/моль). Более устойчивы такие конформации алканов, в которых атомы расположены возможно дальше друг от друга (отталкивание электронных оболочек). Переход от одной конформации к другой осуществляется за счет энергии теплового движения. Для изображения конформации используют специальные пространственные формулы (формулы Ньюмена).
Не путать!
Следует различать понятия конформация и конфигурация.
Разные конформации могут превращаться друг в друга без разрыва химических связей. Для превращения молекулы с одной конфигурацией в молекулу с другой конфигурацией требуется разрыв химических связей.
Из четырех видов изомерии для алканов характерны два: изомерия углеродного скелета и оптическая изомерия (см. часть
I,§7).
Химические связи в алканах, их разрыв и образование определяют химические свойства алканов. Связи С—С и С—Н ковалентные, простые (s-связи), практически неполярные, достаточно прочные, поэтому:
1) алканы вступают чаще всего в такие реакции, которые идут с гемолитическим разрывом связей;
2) по сравнению с органическими соединениями других классов алканы обладают низкой реакционной способностью (их за это называют парафинами — «лишенными свойства»). Так, алканы устойчивы к действию водных растворов кислот, щелочей и окислителей (например, перманганата калия) даже при кипячении.
Алканы не вступают в реакции присоединения к ним других молекул, т.к. алканы не имеют в своих молекулах кратных связей.
Алканы подвергаются разложению при сильном нагревании в присутствии катализаторов в виде платины или никеля, при этом от алканов отщепляется водород.
Алканы могут вступать в реакции изомеризации. Характерной реакцией для них является реакция замещения, протекающая по радикальному механизму.
Химические свойства
Реакции радикального замещения
В качестве примера рассмотрим взаимодействие алканов с галогенами. Фтор реагирует очень энергично (как правило, со взрывом) — при этом рвутся все С—Н и С—С связи, и в результате образуются соединения CF4 и HF. Практического значения реакция не имеет. Иод с алканами не взаимодействует. Реакции с хлором или бромом идут либо при освещении, либо при сильном нагревании; при этом происходит образование от моно- до полигалогензамещенных алканов, например:
СН3—СН3+Сl2 ®hvСН3—СН2—Сl+НСl
Образование галогенопроизводных метана протекает по цепному свободнорадикальному механизму. Под действием света молекулы хлора распадаются на неорганические радикалы:
Сl2«2Сl.
Неорганический радикал Сl. отрывает от молекулы метана атом водорода с одним электроном, образуя НС1 и свободный радикал СН3

Свободный радикал взаимодействует с молекулой хлора Сl2, образуя галогенопроизводное и радикал хлора.

и так далее. К реакциям радикального замещения относится также окисление алканов кислородом воздуха.
Реакция окисления начинается с отрыва атома водорода молекулой кислорода (которая представляет собой бирадикал) и далее идет как разветвленная цепная реакция. Количество радикалов в ходе реакции увеличивается. Процесс сопровождается
выделением большого количества теплоты, рвутся уже не только С—Н, но и С—С связи, так что в результате образуется оксид углерода (IV) и вода. Реакция может протекать как горение или приводит к взрыву.
2СnН2n+2+(3n+1)О2 ®2nСO2+(2n+2)Н2O
При обычной температуре реакция окисления не идет; ее можно инициировать либо поджиганием, либо действием электрического разряда.
При сильном нагревании (свыше 1000°С) алканы полностью разлагаются на углерод и водород. Эта реакция называется пиролизом.
СН4®1200°С+2Н2
При мягком окислении алканов, в частности метана, кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота.
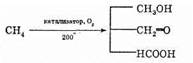
Если метан пропускать через нагретую зону очень быстро, а затем сразу охлаждать водой, то в результате образуется ацетилен.
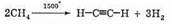
Эта реакция — основа промышленного синтеза, который называется крекингом (неполным разложением) метана.
Крекинг гомологов метана проводят при более низкой температуре (около 600°С). Например, крекинг пропана включает следующие стадии:
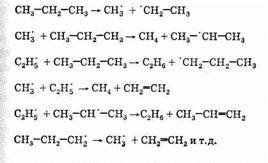
Итак, крекинг алканов приводит к образованию смеси алканов и алкенов меньшей молекулярной массы.
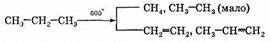
Нагревание алканов до 300-350°С (крекинг еще не идет) в присутствии катализатора (Pt или Ni) приводит к дегидрированию — отщеплению водорода.
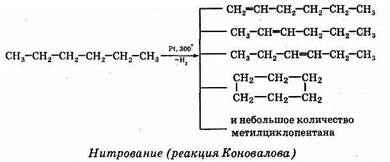
При действии разбавленной азотной кислоты на алканы при 140°С и небольшом давлении протекает радикальная реакция:
СН3—СН3 + HNO3®CH3—CH2—NO2 + Н2О Изомеризация
При определенных условиях алканы нормального строения могут превращаться в алканы с разветвленной цепью.
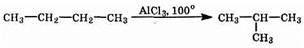
Получение алканов
Рассмотрим получение алканов на примере получения метана. Метан широко распространен в природе. Он является главной составной частью многих горючих газов, как природных (90-98%), так и искусственных, выделяющихся при сухой перегонке дерева, торфа, каменного угля, а также при крекинге нефти. Природные газы, особенно попутные газы нефтяных месторождений, помимо метана содержат этан, пропан, бутан и пентан.
Метан выделяется со дна болот и из каменноугольных пластов в рудниках, где он образуется при медленном разложении растительных остатков без доступа воздуха. Поэтому метан часто называют болотным газом или рудничным газом.
В лаборатории метан получают при нагревании смеси ацетата натрия с гидроксидом натрия:
CH3COONa+NaOH®200° Na2CO3+CH4
или при взаимодействии карбида алюминия с водой: Аl4Сl3+12H2O®4Аl(ОН)3+3CH4
В последнем случае метан получается весьма чистым.
Метан может быть получен из простых веществ при нагревании в присутствии катализатора:
С+2Н2®NiСН4 8 также синтезом на основе водяного газа
CO+3H2®NiCH4+H2O
Этот способ имеет промышленное значение. Однако используют обычно метан природных газов или газов, образующихся при коксовании каменных углей и при переработке нефти.
Гомологи метана, как и метан, в лабораторных условиях получают прокаливанием солей соответствующих органических кислот с щелочами. Другой способ — реакция Вюрца, т.е. нагревание моногалогенопроизводных с металлическим натрием, например:
С2Н5Br+2Na+BrC2H6 ® С2Н5—С2Н5+2NaBr
В технике для получения технического бензина (смесь углеводородов, содержащих 6-10 атомов углерода) применяют синтез
из оксида углерода (II) и водорода в присутствии катализатора (соединения кобальта) и при повышенном давлении. Процесс
можно выразить уравнением
nСО+(2n+1)Н2®200°CnH2n+2+nН2O
I Итак, основным источником алканов служат природный газ и нефть. Однако некоторые предельные углеводороды синтезируют из других соединений.
Применение алканов
Большая часть алканов используется как топливо. Крекинг и
Дегидрирование их приводит к непредельным углеводородам, на
базе которых получают множество других органических веществ.
Метан — основная часть природных газов (60-99%). В состав
природных газов входят пропан и бутан. Жидкие углеводороды
применяются в качестве горючего в двигателях внутреннего сгорания а автомашинах, самолетах и др. Очищенная смесь жидких
и твердых алканов образует вазелин. Высшие алканы являются
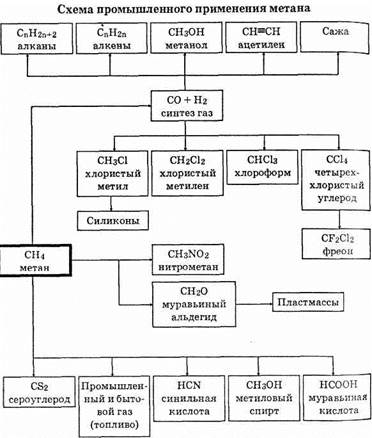
исходными веществами при получении синтетических моющих средств. Алканы, полученные путем изомеризации, используются в производстве высококачественных бензинов и каучука. Ниже приведена схема применения метана
Циклоалканы
Строение
Циклоалканы — насыщенные углеводороды, в молекулах которых имеется замкнутое кольцо из углеродных атомов.
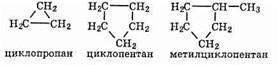
Циклоалканы (циклопарафины) образуют гомологический ряд с общей формулой СnН2n, в котором первым членом является
циклопропан С3Н6, т.к. для образования кольца необходимо наличие не менее трех атомов углерода.
Циклоалканы имеют несколько названий: циклопарафины, нафтены, цикланы, полиметилены. Примеры некоторых соединений:
Формула СnН2n характерна для циклопарафинов, и точно такая же формула описывает гомологический ряд алкенов (непредельных углеводородов, имеющих одну кратную связь). Из этого можно сделать вывод, что каждому циклоалкану изомерен соответствующий алкен — это пример «межклассовой» изомерии.
Циклоалканы по размеру цикла делятся на ряд групп, из которых рассмотрим две: малые (С3, С4) и обычные (С5-С7) циклы.
Названия циклоалканов строятся путем добавления приставки цикло- к названию алкана с соответствующим числом атомов углерода. Нумерацию в цикле проводят так, чтобы заместители получили наименьшие номера.
Структурные формулы циклоалканов обычно записываются в сокращенном виде, используя геометрическую форму цикла и опуская символы атомов углерода и водорода. Например:
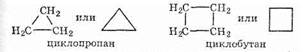
Структурная изомерия циклоалканов обусловлена размером цикла (циклобутан и метилциклопропан — изомеры) и положением заместителей в цикле (например, 1,1- и 1,2-диметилбутан), а также их строением.
Пространственная изомерия также характерна для циклоалканов, т.к. она связана с различным расположением заместителей относительно плоскости цикла. При расположении заместителей по одну сторону от плоскости цикла получаются цис-изомеры, по разные стороны — транс-изомеры.
Дата добавления: 2016-01-03; просмотров: 2967;
