Алкины. Кислотные свойства алкинов
Алкины (ацетилены) — ненасыщенные углеводороды, в молекуле которых налицо по крайней мере одна тройная связь. Они образуют гомологический ряд СnН2n-2.
Согласно систематической номенклатуре названия таких углеводородов образуются путем замены суффикса -ан соответствующих предельных углеводородов на -ин. Как и в случае этиленовых углеводородов, атомы углерода нумеруют, начиная с того конца, к которому ближе кратная (в данном случае тройная) связь:
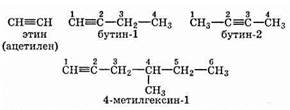

Структурная изомерия алкинов, как и алкенов, обусловлена строением углеродной цепи и положением в ней тройной связи.
В ацетиленовых углеводородах имеются С-атомы, находящиеся в состоянии sp-гибридизации (третье валентное состояние углерода). Две взаимноперпендикулярные p-связи между двумя атомами углерода в молекуле алкина в сумме создают электронное облако (см. рис. 35), близкое к «цилиндрическому» («веретенообразному») облаку s-связи.
Угол между s-связями, образованными гибридными орбиталями, равен 180°. Образующие тройную связь атомы углерода и связанные с ними два соседних атома лежат на одной прямой (см. рис. 36).
Так как облако двух p-связей имеет высокую («цилиндрическую» — см. выше) симметрию, то для нарушения этой симметрии требуется дополнительная затрата энергии. Поэтому алкины, несмотря на большую ненасыщенность, менее активны, чем алкены, вступают в реакции электрофильного присоединения и окисления. Например, обесцвечивание бромной воды и изменение окраски раствора перманганата калия алкинами происходит постепенно (алкены в тех же условиях реагируют практически мгновенно). Многие реакции электрофильного присоединения к алкинам идут лишь в присутствии катализатора.
Вторая особенность электронного строения алкинов — повышенная полярность ацетиленовой связи С—Н. Она обусловлена следующими причинами. Известно, что 2s-электроны в среднем Расположены ближе к ядру, чем 2p-электроны:
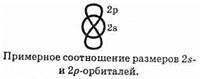
Орбитали ацетиленового атома углерода (sp-гибридные орбитали) содержат значительно больший вклад p-характера, чем sp3-и sp2-орбитали. Это приводит к увеличению электронной плотности вблизи атома углерода. Если такой атом образует за счет sp-орбитали связь, то в ней, соответственно, электронная плотность сдвинута в сторону атома углерода (по сравнению с такой же связью, образованной sp3-гибридизованным атомом). Иными словами можно сказать, что у sp-гибридизованного атома углерода электроотрицательность выше, чем у sp3- и sp2-гибридизованных атомов. Соответственно, у алкинов с тройной связью на конце цепи (терминальных алкинов) соответствующая связь С-Н более полярна, чем в алкенах и алканах, и имеет слабокислотный характер.
Дата добавления: 2016-01-03; просмотров: 1373;
