Глава III. Изомерия комплексных соединений.
Изомерия (греч. «isos» - равный, «meros» - часть) комплексов – одинаковый стехиометрический состав, но разное строение и свойств соединений – может быть не связана с изомерией самого комплексного иона. К наиболее часто встречающимся изомерам такого типа относятся:
- координационная изомерия - различное положение металлов в комплексных катионах и анионах: [Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6].
- координационная полимерия – для данного типа изомерии соединения с одинаковым элементным составом отличаются молекулярной массой: [Pt(NH3)4][PtCl4] и [Pt(NH3)2Cl2] характеризуются одинаковым элементным составом, но разной молекулярной массой.
- гидратная изомерия – изомеры отличаются числом молекул воды во внутренней внешней сфере комплекса: [Cr(H2O)6]Cl3, [Cr(H2O)5Cl]Cl2.H2O, [Cr(H2O)4Cl2]Cl.2H2O, [Cr(H2O)3Cl3].3H2O.
- ионизационная метамерия – изомеры с различным содержанием анионов во внутренней и внешней сфере комплекса: [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2.
Другой тип изомерии связан с изомерными формами самого комплекса. Среди наиболее часто встречающихся изомеров этого типа можно отметить:
1. Геометрическая изомерия – различное пространственное положение лигандов вокруг комплексообразователя. Так, для плоско-квадратных и октаэдрических комплексов с лигандами двух типов (например, NH3 и Cl-) возможно транс- (лат. «trans» напротив) и цис- (лат. «cis» вместе) положение вокруг комплексообразователя (Pt(II) и Pt(IV):
| Транс-[Pt(NH3)2Cl2] |
| Цис-[Pt(NH3)2Cl2] |
| Транс-[Pt(NH3)4Cl2]2+ |
| Цис-[Pt(NH3)4Cl2]2+ |
реберного (англ. «meridional» меридиональный, mer.) и граневого (англ. «facial» лицевой, fac.) положения лигандов NH3 и Cl- ионов вокруг Pt(IV):
| mer-[Pt(NH3)3Cl3]+ |
| fac-[Pt(NH3)3Cl3]+ |
Наличие двух – цис- и транс- изомеров шестикоординационных [MA4B2] комплексов, содержащих два типа лигандов во внутренней сфере, явилось прямым подтверждением их октаэдрической пространственной структуры, предложенной А. Вернером в координационной теории. В отличие от октаэдрического строения, расположения лигандов [MA4B2] комплекса в вершинах плоского шестиугольника приводит к трем геометрическим изомерам с орто-, мета- и пара- положением лигандов B:
2. Лигандная изомерия обусловлена изомерными формами оргаиических лигандов, входящих в состав внутренней сферы комплексов. Так, например, цис- и транс- формы стильбеновой составляющей органических лигандов:
приводит к существованию лигандных изомеров комплексов.
3. Оптическая изомерия связана с явлением оптической активности некоторых соединений – вращением плоскости поляризации света. Оптическая изомерия открыта в 1848 г. Л. Пастером, получившим оптические изомеры винной кислоты с вращением плоскости поляризации света в разных направлениях и высказывавшим гипотезу о зеркальной симметрии оптических изомеров. Основным условием наличия оптической изомерии является ассиметричное строение химического соединения. Так, например, если атом углерода в органическом соединении связан с четырьмя разными атомами или радикалами, то при одном и том же составе возможны два типа пространственного расположения, относящиеся друг к другу как предмет и его зеркальное изображение (рис. 3.1).
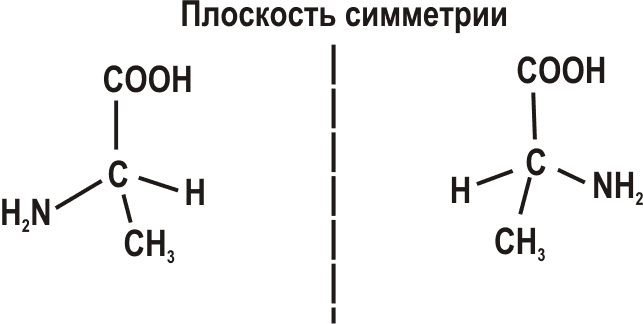
Рис. 3.1. Оптические изомеры.
А. Вернер применил представления Л. Пастера к октаэдрическим комплексам. В отличие от транс-изомера, цис-изомер октаэдрического [CoEn2(NH3)Cl]2+ комплекса не имеет плоскости симметрии, что определяет возможность существования его двух оптических изомеров (рис. 3.2):
Рис. 3.2. Оптические изомеры [CoEn2(NH3)Cl]2+ иона.
В 1911 г. А. Вернер получил два предсказанных оптических изомера октаэдрческого [CoEn2(NH3)Cl]2+ комплекса, что не только подтвердило координационную теорию, но и позволило экспериментально различать геометрические цис- и транс- изомеры октаэдрических комплексов. Ассиметричные трисэтилендиаминовые комплексы также характеризуются (рис. 3.3) наличием оптических изомеров.
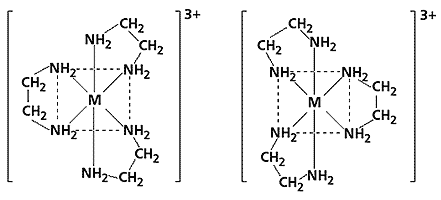
Рис. 3.3. Оптические изомеры [Men3]3+ комплексов.
По сравнению с октаэдрическими, тетраэдрические комплексы имеют оптические изомеры только в случае четырех лигандов разной природы. В настоящее время получены многочисленные оптические изомеры моно- и полиядерных комплексов. Оптически активные комплексы называют хиральными , а оптические изомеры – энантиомерами.
4. Связевая изомерия – это тип изомерии обусловлена координацией к комплексообразователю амбидентатных лигандов (монодентатные лиганды, содержащие два донорных атома) с помощью разных донорных атомов: [Co(NH3)5NO2]2+ и [Co(NH3)5ONO]2+, [Rh(NH3)5NCS]2+ и [Rh(NH3)5SCN]2+.
5. Формальная изомерия – изомерные комплексы отличаются по природе внутрисферных лигандов: [Pt(NH3)(NH2C2H5)Cl2] и [Pt(NH2CH3)2Cl2].
6. Изомерия координационного положения связана с различным составом лигандов у разных комплексообразователей в полиядерных комплексах: [(R3P)2Pt(µ-Cl)2PtCl2] и [Cl(R3P)Pt(µ-Cl)2Pt(PR3)Cl].
7. Структурная изомерия – различный состав периферийных и мостиковых лигандов во внутренней сфере полиядерных комплексов: [(CO)4Co-Co(CO)4] и [(CO)3Co(µ-CO)2Co(CO)3].
8. Аллогональнальная изомерия (греч. «allos» - различный, «genios» - угол) комплексные изомеры различной геометрической структуры (рис. 3.4). Так, например, [Ni{P(C6H5)2(C2H5)}2Br2] существует в плоско-квадратной и тетраэдрической форме, [Mo(CN)8]4- - в растворе существует в форме квадратной антипризмы, тогда как в твердом состоянии в форме додекаэдра.
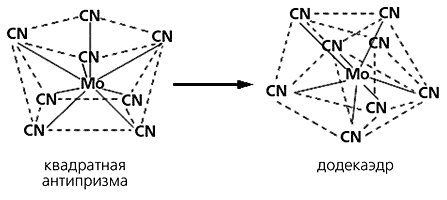
Рис. 3.4. Аллогональные изомеры [Mo(CN)8]4- иона.
9. Спиновая изомерия – существование высоко- и низкоспиновых комплексов одного состава. Наиболее часто встречается у комплексов Fe(III), характеризующихся наличием 5 и 1 неспаренного электрона, например, у хелатных комплексов Fe(III) с тио- и селено-семикарбазонами (рис. 3.5).
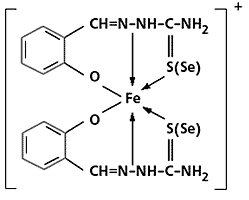
Рис. 3.5. Комплексы Fe(III) с тио- и селено-семикарбазонами.
Приведенные типы изомеров комплексов не исчерпывают все их многообразие, а относятся только к наиболее популярным.
Контрольные вопросы.
1. К какому типу изомерии относятся: а) [Pt(NH3)4][PtCl4] и [Pt(NH3)2Cl2], б) [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2.
2. Приведите примеры координационных и гидратных изомеров комплексов.
3. Определите число геометрических изомеров и изобразите расположение лигандов в следующих октаэдрических и плоско-квадратных комплексах: а) [Cr(NH3)4Cl2]+, б) [Zn(NH3)2Cl2], в) [PdEn2Br2], г) [Pt(NH3)3Cl3]+, д) [Co(NH3)2Cl2Br2]- ?
4. В чем состояло значение геометрической изомерии для признания координационной теории А. Вернера?
5. В чем заключается сущность связевой изомерии, для комплексов с какими лигандами она наблюдается?
6. Какие из приведенных комплексов являются хиральными: а) транс-[Ir(C2O4)2Cl2]3- или цис-[Ir(C2O4)2Cl2]3-, б) [Pd(NH3)4]2+ или [Pd(NH3)(H2O)ClBr] ?
7. В чем состояло значение открытия оптической изомерии комплексов?
8. Приведите пример формальных изомеров комплексов.
9. В чем заключается различие между изомерными комплексами координационного положения?
10. Чем отличаются аллогональные изомеры комплексов?
11. Какое число неспаренных электронов имеют спиновые изомера комплексов Ni(II) ?
12. Чем отличаются лигандные изомеры комплексов?
Дата добавления: 2016-01-03; просмотров: 5717;
