Влияние водородной связи на физические и химические свойства водородных соединений.
Ассоциация водородных соединений
Наличие межмолекулярной водородной связи приводит к более или менее выраженной ассоциации молекул, возможной в любом из трёх агрегатных состояний. Особенно часто происходит ассоциация молекул, содержащих ОН-группы —Н2О, Н2О2, спирты, фенолы, кислородсодержащие неорганические и органические кислоты(например, H2SO4 и HCOOH).Ассоциация имеет место в структурах некоторых кислых солей, например, у NaHCO3 и KH2PO4 ,а также в жидких фтороводороде, аммиаке и циановодороде. В результате ассоциации могут образовываться димеры, линейные или цепочечные полимерные частицы.
Установлено, что в газообразном HF существует несколько видов молекул (HF)n c n=1–6. Среди них молекула (HF)6 особенно устойчива благодаря образованию дополнительной водородной связи при замыкании кольца.
Молекулы HF и HCN в жидком состоянии ассоциированы в цепи вида: (рис.24 ).Фторид водорода в обычных условиях – бесцветная жидкость(tкип =19,5оС). Даже в состоянии газа фторид водорода состоит из смеси полимеров H2F2,H3F3,H4F4,H5F5,H6F6.Простые молекулы HF существуют лишь при температурах выше 90оС. У фтороводорода расстояния H– F и F…H, т.е. протон располагается посередине между ионами фтора.
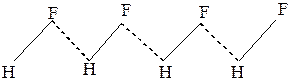
.…H−C ≡N.…H −C≡ N….H− C≡ N….
Рис. 24Водородные связив HF и HCN
Молекула воды может образовывать четыре водородные связи, так как имеет два атома водорода и две несвязывающие электронные пары
(рис.25 ).
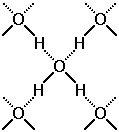
Рис.25 Водородные связи в Н2О
Энергия водородной связи для соединений кислорода с водородом
(13–29 кДж/моль) меньше, чем энергия ковалентной связи. И тем не менее, эта связь обусловливает существование в парах димерных молекул (Н2О)2 и муравьиной кислоты. В ряду сочетаний атомов НF, HO, HN, HCl, HS энергия водородной связи падает вследствие уменьшения электроотрицательности. Она также уменьшается с повышением температуры, поэтому вещества в парообразном состоянии проявляют водородную связь лишь в незначительной степени. В большей степени она характерна для веществ в жидком и твердом состояниях.
Тенденция к образованию водородных связей объясняет также строение гидратированного иона протона.Результаты экспериментов показывают что в воде протон присутствует как Н9О4+.Поэтому схему автопротолиза воды Н2О + Н2О = Н3О+ можно рассматривать лишь как чисто символическую. Ион Н9О4+ имеет пирамидальное строение.Центральный атом кислорода связан тремя сильными водородными связями с тремя молекулами воды(рис.26 ).
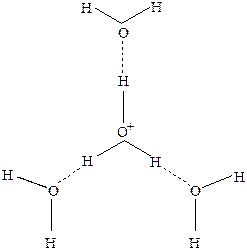
Рис.26 Строение иона Н9О4+
Аномалия температур плавления и кипения
Известно, что соединения водорода с сильно электроотрицательными неметаллами, такими как F, О, N, имеют аномально высокие температуры кипения. Температуры плавления и кипения соединений определяются энергией межмолекулярного взаимодействия: чем выше энергия взаимодействия, тем больше поглощённой энергии расходуется на преодоление сил сцепления, тем при более высоких температурах плавится и кипит вещество. Поэтому соединения, образующие прочные межмолекулярные водородные связи, обладают аномально высокими температурами плавления и кипения. Если в ряду Н2Тe – H2Se – H2S температура кипения закономерно уменьшается, то при переходе от H2S к Н2О наблюдается резкий скачок к увеличению этой температуры. Такая же картина наблюдается и в ряду галогеноводородных кислот. Это свидетельствует о наличии специфического взаимодействия между молекулами Н2О, молекулами HF—образование ассоциатов посредством межмолекулярных водородных связей. Благодаря водородным связям молекулы объединяются в димеры и полимеры. Такое взаимодействие должно затруднять отрыв молекул друг от друга, т.е. уменьшать их летучесть, а, следовательно, повышать температуру кипения соответствующих веществ (см. табл.2).
| Вещество | tплоС | tкипоС | Вещество | tплоС | tкипоС |
| H2O | 0,0 | 100,0 | HF | –83,1 | 19,5 |
| H2S | –85,5 | –60,7 | HCl | –112,0 | –84,9 |
| H2Se | –64,8 | –41,5 | HBr | –87,0 | –66,8 |
| H2Te | –49,0 | –2,0 | HI | –50,9 | –39,4 |
Табл.2 Температуры плавления и кипения водородных соединений
Дата добавления: 2016-01-07; просмотров: 2108;
