Соли, гидроксиды и комплексные соединения элементов 10 группы
Хотя для всех металлов десятой группы наиболее стабильной является степень окисления +2, с увеличением порядкового номера элемента наблюдается тенденция к росту устойчивости соединений в степени окисления +4. Взаимные переходы между этими двумя степенями окисления наиболее характерны для комплексов платины. Как и в других группах переходных элементов, с увеличением порядкового номера возрастает доля ковалентности связи металл-лиганд, что препятствует образованию простых катионных форм, например, солей, и увеличивает устойчивость комплексных соединений, преимущественно анионных. Так, из водных растворов ионы никеля(II) в отсутствии конкурирующих лигандов выделяются в форме аквакомплексов.; это менее характерно для палладия(II) и совсем нетипично для платины(II).
Cоединения в степенях окисления –1, 0, +1.
Нульвалентное состояние металлов стабилизируют мягкие лиганды с π-акцепторными свойствами – цианиды, карбонил, непредельные углеводороды, фосфины. Образование π-связи металл-лиганд в этом случае приводит к уменьшению отрицательного заряда на атоме металла с электронной конфигурацией d10. По комплексообразующей способности все три металла десятой группы сходны друг с другом. Для них характерны низкие координационные числа и координационно-ненасыщенные соединения.
В отличие от палладия и платины, никель при слабом нагревании в атмосфере СО образует карбонил Ni(CO)4, представляющий собой ядовитую бесцветную жидкость (т. кип. 42 °C) и состоящий из тетраэдрических молекул. На воздухе вещество легко окисляется, а растворы щелочных металлов в жидком аммиаке восстанавливают его до карбонильных кластеров [Ni5(CO)12]2– и [Ni6(CO)12]2–. Для палладия и платины также известны карбонильные кластеры, построенные из треугольников М3, расположенных параллельно друг другу и соединенных связями металл-металл (Рис.6.46 (а) Строение аниона [Pt9(CO)18]2–, (б) каркас кластерного аниона [Pt38(CO)44]2–). В более сложном анионе [Pt38(CO)44]2– (рис.6.46 б) расположение всех карбонильных лигандов не удается установить методом рентгеноструктруного анализа из-за большого числа тяжелых атомов. Эти соединения получают восстановлением гексахлороплатинатов с помощью СО. (Сноска: Карбонилы палладия подробно рассмотрены в обзоре: Т.А. Стромнова, И.И. Моисеев, Успехи химии, 1998, 67, 542)
Восстановление цианидного комплекса никеля(II) калием в жидком аммиаке приводит к образованию желтого осадка диамагнитного гексацианоникелата(0) K4[Ni(CN)4]. Триметилфосфит восстанавливает хлорид никеля(II) до комплекса [Ni(P(OMe)3)4], а борогидрид натрия в присутствии трифенидфосфина превращает [PdCl4]2– в Pd(PPh3)4. Все эти вещества состоят из тетраэдрических молекул, что соответствует расположению лигандов на наиболее удаленном расстоянии друг от друга. Отсутствие стабилизации кристаллическим полем (конфигурация d10) свидетельствует о существенном ковалентном вкладе, вызванном перекрыванием заполненных d-орбиталей металла и вакантных орбиталей лиганда.
Многие из этих веществ вступают в реакции окислительного присоединения, однако, в отличие от родия и иридия, эти процессы, как правило, не сопровождаются увеличением координационного числа:

Соединения в степени окисления +2.
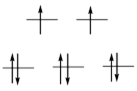
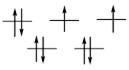
Степень окисления +2 наиболее устойчива для всех трех элементов, если не принимать во внимание, что платиновые металлы наиболее стабильны в форме простых веществ. Ионы этих металлов имеют электронную конфигурацию d8, для которой при высоком значении энергии расщепления Δ оказываются устойчивыми плоско-квадратные комплексы. Так как эта энергия значительно возрастает в ряду Ni-Pd-Pt, палладий и платина образуют исключительно плоско-квадратные комплексы, даже с лигандами слабого поля (табл.). Для никеля существует большое разнообразие геометрий, выбор которых зависит от совместного влияния стерических и электронных факторов.
Таблица. Комплексы металлов десятой группы с различной геометрией
| Геометрия комплекса | Октаэдрический | Тетраэдрический | Квадратный |
| Расщепление орбиталей |
|
| 
|
| Магнитные свойства | парамагнитный | Парамагнитный | диамагнитный |
| Комплексы Ni(II) | с лигандами слабого поля и хелатирующими | с объемными лигандами | с лигандами сильного поля и объемными хелатирующими |
| Окраска комплексов Ni(II) | зеленая, фиолетовая | Желто-зеленая | красно-коричневая |
| Комплексы Pd(II) и Pt(II) | – | – | со всеми лигандами |
| Примеры | [Ni(H2O)6]2+, [Ni(NH3)6]2+, Ni3(acac)6 | [NiCl4]2–, NiBr2(PPh3O)2 | [Ni(CN)4]2–, [Pd(H2O)4]2+, Pt(NH3)2Cl2 |
Многие соединения никеля(II) по строению, физическим и некоторым химическим свойствам напоминают аналогичные соединения кобальта(II), что объясняется близостью ионных радиусов. Однако, в отличие от кобальта, соединения никеля гораздо более устойчивы к окислению, и на воздухе существуют даже в сильно щелочных средах.
Ион гексаакваникеля(II) придает растворам солей и кристаллогидратам яркую зеленую окраску. Нитрат Ni(NO3)2×6H2O, сульфат NiSO4×7H2O («зеленый купорос») и перхлорат Ni(ClO4)2×6H2O изоморфны аналогичным соединениям кобальта. Интересно, что гексагидрат хлорида никеля, в отличие от хлорида кобальта, представляет собой молекулярный комплекс транс-[Ni(H2O)4Cl2]×2H2O, однако, в растворе атомы хлора замещаются молекулами воды. Хотя скорость обмена воды в координационной сфере [Ni(H2O)6]2+ на два порядка ниже, чем для аналогичных ионов железа и кобальта, в целом комплексы никеля(II) являются лабильными.
При действии щелочей на водные растворы солей никеля выпадает яблочно-зеленый студенистый осадок гидроксида Ni(OH)2, со временем приобретающий структуру, аналогичную гидроксидам кобальта(II) и железа(II) (Рис.6.34). Он является основанием (Kb = 2,5×10–5) и, в отличие от гидроксида кобальта(II), не растворяется даже в концентрированных щелочах.
Сульфат никеля образуется при растворении металла в 30 %-ной серной кислоте, в которую для ускорения реакции добавляют азотную кислоту. На холоду он кристаллизуется из водных растворов в виде гептагидрата NiSO4×7H2O, который при нагревании до 280 °C полностью отщепляет воду, превращаясь в желтый порошок. Выше 700 °C NiSO4 разлагается на оксид NiO, сернистый газ и кислород. С сульфатами щелочных металлов сульфат никеля образует двойные соли M2Ni(SO4)2×6H2O, по строению напоминающие соль Мора. При действии на сульфат никеля щелочью, взятой в недостатке, образуются основные сульфаты, которые под действием щелочи легко переходят в гидроксид. Сульфиты никеля по составу и свойствам напоминают сульфиты кобальта.
Нитрат никеля Ni(NO3)2×6H2O образует красивые изумрудно-зеленые кристаллы. Выше 150 °C он разлагается с образованием основной соли, а при 350 °C – оксида.
Яблочно-зеленый хлопьевидный осадок фосфата Ni3(PO4)2×7H2O образуется аналогично фосфату кобальта. Он взаимодействует с кислотами и с раствором аммиака. При осаждении фосфатом аммония образуется двойная соль [Ni(H2O)6]NH4PO4. Получены также фосфиты NiHPO3×H2O, Ni11(HPO3)8(OH) и даже гипофосфиты Ni(H2PO2)2(H2O)6, Ni(H2PO2)Cl×H2O (Marcos M.D., Amoros P., et al, Chem. Mater., 1993, 5, 121; Inorg. Chem., 32, 5044).
Средний карбонат никеля NiCO3×6H2O получают осаждением гидрокарбонатом. Обезвоживание соли нагреванием в открытом сосуде приводит к ее гидролизу, поэтому безводный продукт получают нагреванием гидрата в запаянной ампуле. При использовании гидрокарбоната аммония образуются мелкие яблочно-зеленые кристаллы двойной соли (NH4)HCO3×NiCO3×4H2O. Действие на соли никеля растворами средних карбонатов приводит к образованию различных основных солей, например, Ni3CO3(OH)4×4H2O. При нагревании суспензии основного карбоната в автоклаве в атмосфере углекислого газа может быть получен светло-зеленый порошок кислой соли Ni(HCO3)2. Известен также карбонатный комплекс K2[Ni(CO3)2(H2O)4] (Zheng Y.Q., Adam A., Acta Cryst. C., 1994, 50, 1422).
Среди силикатов никеля наиболее известен островной ортосиликат Ni2SiO4, встречающийся в природе в виде минерала либенбергита. Он образуется при спекании оксида никеля с кремнеземом.
Ацетат и оксалат никеля по строению и свойствам близки к аналогичным соединениям кобальта.
Для химии никеля(II) практически не характерны восстановительные свойства, о чем говорит, например, возможность получения кристаллической соли с таким сильным окислителем как пербромат. Гидроксид никеля(II), в отличие от гидроксида кобальта, не окисляется пероксидом водорода, а реагирует лишь с более сильными окислителями, например, гипохлоритом.
При действии на соли никеля избытком концентрированного раствора аммиака образуется фиолетовый раствор, содержащий гексаамминокомплексы:
[Ni(H2O)6]2+ + 6NH3  [Ni(NH3)6]2+ + 6H2O, K = 1.02×108
[Ni(NH3)6]2+ + 6H2O, K = 1.02×108
Никель, таким образом, гораздо легче образует аммиакаты, чем марганец, железо и кобальт: значения констант устойчивости амминокомплексов существенно возрастают при движении по 3d-ряду. Гексааммиакаты легко кристаллизуются при наличии в растворе объемного аниона, например, иодида, перхлората или гексацианоферрата(II). При нагревании или длительном хранении они отщепляют часть аммиака, превращаясь в зеленые тетраммины. Действием раствора аммиака на нитрат или сульфат никеля получают фиолетовые растворы из которых кристаллизуются соли тетраамминдиакваникеля(II), например, транс-[Ni(NH3)4(H2O)2](NO3)2. Молекулы воды в координационной сфере никеля могут быть замещена на нитрит, тиоцианат и другие лиганды. При замещении воды в катионе гексаакваникеля на нитрит-ионы образуется нитро-комплекс K4[Ni(NO2)6] (Grey I.M., Hitchman M.A., et al, Journ. Chem. Soc., Dalton Trans., 1994, 95).
Никелаты(II), например, K2NiO2, BaNiO2, Ba3NiO4 получают спеканием оксидов или карбонатов. В составе K2NiO2 содержатся линейные ионы [O–Ni–O]2– (Rieck H., Hoppe R., Z. Anorg. Allg. Chem., 1973, 400, 311; Hoppe R., et al, Inorg. Chem., 1988, 27, 2506)
Замена воды на молекулы аммиака в координационной сфере никеля приводит к изменению окраски от ярко-зеленой до сине-фиолетовой. Это объясняется увеличением энергии расщепления Δo в ряду H2O – NH3, что и обусловливает смещение полос поглощения в электронном спектре (Рис.6.47. Электронные спектры поглощения ионов (а) [Ni(H2O)6]2+ , (б) [Ni(NH3)6]2+ ).
Действием ацетилацетона на раствор соли никеля(II) в присутствии основания получают голубой осадок гидрата транс-Ni(acac)2(H2O)2, представляющий собой октаэдрический комплекс. При нагревании в вакууме он теряет воду и сублимируется в форме зеленого тримера Ni3(acac)6 (рис. г), в котором все атомы никеля сохраняют октаэдрическую геометрию.
Плоско-квадратные комплексы никеля существуют преимущественно с лигандами сильного поля, вызывающими значительное расщепление. Примерами могут служить желтый тетрацианоникелат(II) [Ni(CN)4]2–, красный диметилглиоксимат Ni(Hdmg)2, предложенный Чугаевым в качестве реактива на ионы никеля (Рис.6.48 Диметилглиоксим (H2dmg) и диметилглиоксимат никеля Ni(Hdmg)2). Дикетонаты никеля(II) с объемными заместителями, например, трет-бутилом, также имеют плоско-квадратную геометрию. Некоторые из них могут быть получены в виде двух изомеров – зеленого тримера с октаэдрической координацией никеля и красного мономера с плоско-квадратной геометрией.
Тетраэдрические комплексы характеризуются незначительной величиной энергии расщепления и устойчивы исключительно благодаря тому, что в тетраэдре лиганды расположены на максимальном удалении друг от друга. Геометрический фактор становится наиболее значимым в случае объемных лигандов, которые при расположении в одной плоскости испытывают значительное взаимное отталкивание. Наиболее изучены галогенидные комплексы, которые легко кристаллизуются из этанольных растворов в присутствии объемных катионов:
NiCl2 + 2[NBu4]Cl = [NBu4]2[NiCl4].
Поскольку квадратные комплексы более благоприятны энергетически, а тетраэдрические – благодаря стерическому фактору, в некоторых случаях между обеими формами существует равновесие. Взаимные превращения квадрат  тетраэдр сопровождаются изменением спина, распариванием электронов и поэтому замедленны настолько, что их легко наблюдать. Бромидный комплекс никеля с этилдифенилфосфином при охлаждении становится плоско-квадратным, а при повышении температуры до комнатной – тетраэдрическим. Этот переход сопровождается изменением магнитного момента и окраски (Рис.6.49. Изомеризация бромидного комплекса никеля(II) с этилдифенилфосфином NiBr2(PEtPh2)2).
тетраэдр сопровождаются изменением спина, распариванием электронов и поэтому замедленны настолько, что их легко наблюдать. Бромидный комплекс никеля с этилдифенилфосфином при охлаждении становится плоско-квадратным, а при повышении температуры до комнатной – тетраэдрическим. Этот переход сопровождается изменением магнитного момента и окраски (Рис.6.49. Изомеризация бромидного комплекса никеля(II) с этилдифенилфосфином NiBr2(PEtPh2)2).
Возможность повышения координационного числа от четырех до пяти и шести объясняет способность плоско-квадратных комплексов никеля присоединять дополнительные лиганды, образуя красные пятикоординационные комплексы:
[Ni(CN)4]2– + CN–  [Ni(CN)5]3–, K = 0.2.
[Ni(CN)5]3–, K = 0.2.
Крупные катионы позволяют выделить пентацианоникелат в кристаллическом виде, например, [Cr(en)3][Ni(CN)5]. В зависимости от природы катиона ион имеет форму квадратной пирамиды или тригональной бипирамиды.
Фторид-ионы, обладая небольшим радиусом, образуют октаэдрические комплексы. Интересно, что соль состава K2[NiF4] состоит из октаэдров [NiF6], частично связанных общими вершинами в структуру, производную от структуры перовскита (Рис.6.50. Строение K2[NiF4]).
При движении вниз по группе устойчивость степени окисления +2 постепенно понижается. Если для палладия она по-прежнему является наиболее устойчивой и соединения палладия(II) практически не проявляют восстановительных свойств, то комплексные соединения платины легко могут быть окислены до +4. В ряду Ni-Pd-Pt уменьшается склонность к образованию простых катионных форм, выражающаяся в том, что соли платины практически неизвестны.
Соединения палладия(II) и платины(II) с любыми лигандами, подобно комплексам никеля(II) с лигандами сильного поля, являются низкоспиновыми, диамагнитными и имеют плоско-квадратную геометрию, что объясняется существенным увеличением энергии расщепления при движении вниз по группе. Важным свойством этих комплексов является их кинетическая инертность, особенно ярко выраженная у платины. Это позволило тщательно изучить механизм замещения в плоско-квадратных комплексах платины(II) и выявить факторы, влияющие на направление протекания процесса.
Из раствора полученного растворением палладия в азотной кислоте кристаллизуются коричневые кристаллы нитрата Pd(NO3)2(H2O)2, имеющие молекулярное строение (Laligant Y., Ferey G., Le Bail A., Mater. Research Bull., 1991, 26, 269) (Рис.6.51. Строение Pd(NO3)2(H2O)2). Азотный ангидрид отнимает от него воду, переводя в безводную соль Pd(NO3)2, содержащую мостиковые нитратные-группы. В концентрированных растворах нитрата в координационную сферу палладия входит анион NO3–, а при разбавлении раствора происходит гидролиз, заканчивающийся выпадением студенистого желтовато-коричневого осадка гидратированного оксида PdO×nH2O. При хранении он темнеет, частично теряя воду, однако полной дегидратации достичь не удается вследствие его частичного разложения на простые вещества. Растворы оксида палладия в хлорной кислоте содержат плоско-квадратные катионы [Pd(H2O)4]2+ , однако кристаллических структур, в которых бы они присутствовали, пока не известно.
При взаимодействии гидратированного оксида палладия с щелочами образуются тетрагидроксопалладаты, в состав которых входит плоско-квадратный ион [Pd(OH)4]2– (Ильинец А.М., Иванов-Емин Б.Н., Петрищева Л.П. и др., Координац. хим., 1987, 13, 1660; Зайцев Б.Е., Иванов-Емин Б.Н., Петрищева Л.П. и др., Журн. неорган. хим., 1991, 36, 134).
При выпаривании раствора, полученного взаимодействием металла со смесью серной и азотной кислот, выделяются темно-красные кристаллы сульфата PdSO4. На воздухе соль расплывается вследствие гидролиза. Из раствора нитрата палладия цианид-ионы осаждают желтую соль Pd(CN)2. Красный роданид Pd(SCN)2 получают действием на K2PdCl4 роданидом аммония. В избытке соли он растворяется, образуя комплекс K2[Pd(SCN)4]. Коричневый перхлорат Pd(ClO4)2(H2O)4 получают выпариванием раствора палладия в смеси азотной и хлорной кислот до появления паров хлорной кислоты.
Для платины(II) простые неорганические соли, содержащие аква-ионы, неизвестны, хотя доказано, что ионы [Pt(H2O)4]2+ содержатся в растворах, полученных действием на K2[PtCl4] перхлората серебра. Неустойчивость аква-катиона платины отчасти объясняется легкостью депротонирования координированных молекул воды с образованием гидроксокомплексов, часто представляющих собой димеры. При действии щелочи на тетрахлороплатинаты(II) или на растворы перхлората платины(II) при рН = 4 выпадает белый осадок гидратированного оксида PtO×H2O (L.J. Elding, Inorg. Chim. Acta, 1976, 20, 65), который, в отличие от аналогичного соединения палладия, легко окисляется на воздухе до черного PtO2, а при нагревании в инертной атмосфере образует смесь диоксида и платины. В избытке щелочи может быть получен раствор, содержащий гидроксоплатинаты(II) [Pt(OH)4]2– однако, при попытке концентрирования они диспропорционируют на платину и [Pt(OH)6]2–.
Восстановлением платинохлористоводородной кислоты H2[PtCl6] формиатом в уксуснокислой среде получен ацетат платины, представляющий собой тетрамерный кластер Pt4(CH3COO)8 (Рис.6.52 а) (Рис.6.52 Строение ацетатов платины (а) и палладия (б)). Аналогичное соединение палладия представляет собой тример Pd3(CH3COO)6, но без связей металл-металл (Рис.6.50 б). Его получают взаимодействием палладия с ледяной уксусной кислотой, содержащей небольшое количество азотной кислоты. В обоих соединениях атом металла находится в плоско-квадратном окружении из атомов кислорода. При растворении в органических растворителях, например, в бензоле, тримеры, в отличие от тетрамеров, распадаются.
Координационная химия палладия(II) и платины(II) имеет много общего, что позволяет обсуждать их комплексы вместе.
Важнейшим исходным соединением палладия является тетрахлоропалладат(II) калия K2[PdCl4], выпадающий в виде желтовато-коричневых кристаллов при добавлении хлорида калия к раствору палладия в царской водке, несколько раз выпаренному и растворенному в соляной кислоте для удаления нитрат-ионов. Аналогичную платиновую соль, часто называемую тетрахлороплатинитом (тетрахлороплатинатом(II)), получают восстановлением гексахлороплатината(VI) K2PtCl6 гидразином или оксалатом калия:
2K2[PtCl6] + K2C2O4 = 2K2[PtCl4] + 2KCl + 2CO2
При охлаждении раствора соль выделяется в виде призматических кристаллов красного цвета, малорастворимых в холодной воде. В водных растворах тетрахлоропалладатов(II) и тетрахлороплатинатов(II) существуют сложные равновесия между ионом [MCl4]2– и продуктами замещения в них атомов хлора на молекулы воды. Константа равновесия реакций замещения имеет более высокие значения в случае платины,
[PtCl4]2– + H2O 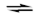 [PtCl3(H2O)]– + Cl–, K = 1.34×10–2
[PtCl3(H2O)]– + Cl–, K = 1.34×10–2
но благодаря инертности процесс протекает с крайне низкой скоростью.
При взаимодействии ионов [MCl4]2– с избытком водного раствора аммиака образуются бесцветные растворы тетрамминов [M(NH3)4]2+, выделенные в твердом виде со многими анионами. Хлорид тетрамминплатины(II) [Pt(NH3)4]Cl2 исторически называют хлоридом первого основания Рейзе. Действием на него влажным оксидом серебра(I) удается получить само основание Рейзе [Pt(NH3)4](OH)2. Подобно щелочам, оно поглощает из воздуха углекислый газ, превращаясь в карбонат:
[Pt(NH3)4](OH)2 + CO2 = [Pt(NH3)4]CO3 + H2O.
Сливание растворов хлорида тетрамминплатины(II) и тетрахлороплатината(II) приводит к выпадению темно-зеленых кристаллов соли Магнуса
[Pt(NH3)4]Cl2 + K2[PdCl4] = [Pt(NH3)4][PtCl4] + 2 KCl,
в структуре которого чередуются плоско-квадратные ионы [Pt(NH3)4] и [PtCl4] (Рис.6.53. Строение соли Магнуса (а) кристаллическая решетка (атомы водорода не показаны), (б) перекрывание d-орбиталей атомов платины). Характерный цвет этого соединения, не представляющий собой наложение окрасок исходных веществ, свидетельствует о взаимодействии атомов платины, входящих в состав катиона и аниона путем частичного перекрывания d-орбиталей (Pt-Pt 0.325 нм). Аналогичное соединение палладия имеет розовый цвет. Известен иодид [Pt(NH3)4][PtI4] с расстоянием Pt-Pt 0.347 нм при 293 К и 0.344 нм при 173 К (J.S. Casas, Y. Parajo, Y. Romero, et al, Z. Anorg. Allg. Chem., 2004, 630, 980).
При нагревании соль Магнуса и хлорид тетрамминплатины(II) разлагаются, образуя светло-желтые кристаллы транс-диамминдихлороплатины транс-Pt(NH3)2Cl2, называемыми хлоридом второго основания Рейзе:
250 °C
[Pt(NH3)4]Cl2 ¾¾¾® транс-Pt(NH3)2Cl2 +2NH3.
Другим методом синтеза этого вещества служит реакция между тетраммином и концентрированной соляной кислотой:

Действием на транс-диамминдихлороплатину(II) водной суспензией оксида серебра(I) получают второе основание Цейзе транс-Pt(NH3)2(OH)2.
Цис-диамминдихлороплатина, называемая солью Пейроне, образуется при замещении атомов хлора в тетрахлороплатинате(II) на молекулы аммиака:

Она входит в состав противоопухолевого препарата цисплатина. Его лечебное действие основано на том, что цис-Pt(NH3)2Cl2 образует с гуанином, входящим в состав ДНК, комплекс (Рис.6.54. Строение комплекса гуанина с цис-диамминдихлороплатиной), тем самым подавляя репликацию. Так как опухолевые клетки растут намного быстрее обычных, цисплатин замедляет их рост. Установлено, что противоопухолевой активностью обладают лишь электронейтральные комплексы платины с моно- и диаминами, в транс-положении к которым находятся анионные лиганды на расстоянии 0,34 нм друг от друга – это соответствует шагу между спиралями ДНК. В настоящее время на смену цисплатину пришли препараты второго поколения, содержащие комплексы PtCl2(OH)2(i-C3H7NH2)2, Pt(en)L, где H2L – малоновая кислота и
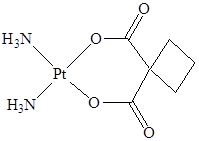
По сравнению с цис-платином, они обладают лучшей растворимостью и значительно меньшей токсичностью (J.L. van der Veer, J. Reedijk, Chem. Britain, 1988, 780).
Последовательность замещения лигандов в комплексах платины определяется влиянием лиганда, расположенного в транс-положении к уходящей группе. По силе транс-влияния лиганды располагаются в ряд, определенный экспериментально на комплексах платины(II):
CO, CN-, C2H4 > H- > CH3 > NO2-, I- > Br- > Cl- > py, NH3 > H2O, OH-
При замещении молекул аммиака в катионе тетрамминплатины(II) на хлорид-ионы сначала образуется комплекс [Pt(NH3)3Cl]+, в котором присутствуют два типа лигандов. Из них большим транс-эффектом обладает атом хлора, поэтому на следующей стадии происходит замещение молекулы аммиака, расположенной в транс-положении к атому хлора, что и приводит к образованию транс-изомера. Если исходить из K2[PtCl4], то в образующемся вначале анионе [Pt(NH3)Cl3]– в силу большего транс-влияние хлора будет образовываться цис-дихлородиамминплатина(II). В установление закономерностей транс-влияния и объяснения его причин большой вклад внесли русские химики Н.С. Курнаков и С.И. Черняев. Для идентификации изомеров Н.С. Курнаков разработал специальный тест, основанный на том, что в цис-диамминдихлороплатине(II) все четыре лиганда легко замещаются тиомочевиной (tu), а в транс-изомере – лишь молекулы аммиака (Н.С. Курнаков, Журн. практич. хим., 1894, 50, 481):
цис-[Pt(NH3)2Cl2] + 4tu = [Pt(tu)4]Cl2 + 2NH3,
транс-[Pt(NH3)2Cl2] + 2tu = [Pt(NH3)2(tu)2]Cl2
ДОПОЛНЕНИЕ. Реакции замещения в плоско-квадратных комплексах.
Скорость реакций замещения в комплексах платины настолько низка, что эти реакции можно легко исследовать. Многочисленными экспериментами надежно установлено, что замещение в плоско-квадратных комплексах платины, за исключением нескольких случаев, протекает по ассоциативному механизму. Пренебрегая участием растворителя, ход процесса можно представить в виде схемы (Рис.6.55. Ход реакции замещения и энергетическая кривая), в которой уходящая группа обозначена символом X, атакующая частица (нуклеофил) Y, лиганды, находящиеся в исходном комплексе в цис-положении к уходящей группе С, а лиганд в транс-положении Т. Реакция начинается с атаки нуклеофила Y, который взаимодействует с атомом металла, увеличивая его координационное число до пяти. В первоначальный момент такого взаимодействия интермедиат имеет геометрию квадратной пирамиды, однако, постепенно она трансформируется в более устойчивую тригонально-пирамидальную. Ей отвечает минимум на потенциальной кривой. Обратите внимание, что в тригонально-пирамидальном интермедиате лиганд Т оказывается расположенным в экваториальной плоскости, где находится также и уходящая группа, а лиганды С – в аксиальных вершинах тригональной бипирамиды. Именно благодаря этому, на легкость протекания замещения влияет именно лиганд Т, который в исходном комплексе находится в транс-положении к уходящей группе. На последующей стадии превращения интермедиат вновь приобретает квадратно-пирамидальную форму, но в аксиальном положении теперь оказывается уходящая группа Х. Ее отщепление приводит к образованию нового плоско-квадратного комплекса. На скорость протекания реакций замещения особенно сильно влияют природа нуклеофильного реагента Y, лиганда Т, уходящей группы Х. Реакционная способность реагента оценивается по его нуклеофильности, то есть сродству к данному реакционному центру (Сноска: Этим нуклеофильность принципиально отличается от основности: основность – это сродство к протону, в случае платины частицы с высокой основностью, такие как CH3O-, OH- являются слабыми нуклеофилами), в рассматриваемом случае – к платине(II). Платина, как известно, является мягкой кислотой, поэтому к ней особенно сильно тяготеют «мягкие» нуклеофилы, содержащие атомы иода (I-), серы (SCN-), азота (NO2-, py, NH3), фосфора (PR3). Именно с этими лигандами замещение протекает с наибольшей скоростью. Влияние лиганда, расположенного в транс-положении к уходящей группы, на скорость реакции носит название транс-эффекта. Его природа обусловлена суммарным действием двух факторов: (1) сильной конкуренцией лигандов Т и Х за р-орбиталь платины, которое ослабевает в переходном состоянии; чем сильнее донорные свойства транс-лиганда, тем выше конкуренция между лигандами в основном состоянии и тем благоприятнее образование интермедиата, то есть протекание реакциии (термодинамический транс-эффект) (Рис.6.56 а) (Рис.6.56 Природа транс-эффекта: (а) взаимодействие р-орбиталей платины с орбиталями лиганда Т в основном и переходном состояниях, (б) взаимодействие dx2-y2 орбитали платины и молекулярных орбиталей лиганда Т в переходном состоянии); (2) стабилизацией переходного состояния π-акцепторными лигандами за счет взаимодействия вакантной dx2-y2 орбитали платины и молекулярных орбиталей лиганда Т (Рис.6.56 б) (кинетический транс-эффект). Эскпериментально установленный ряд транс-влияния выражает суммарное действие этих двух эффектов. Чем более сильным транс-влиянием обладает лиганд, тем худшей уходящей группой он является.
КОНЕЦ ДОПОЛНЕНИЯ
При действии на тетрахлороплатинат(II) насыщенным раствором цианида калия образуются голубые кристаллы цианидного комплекса K2[Pt(CN)4], обладающие плеохроизмом, а при пропускнии этилена один из атомов хлора замещается на молекулу С2Н4, образующую с платиной π-связь:

Реакцию проводят в солянокислой среде в атмосфере азота. При охлаждении из раствора выделяются желтые игольчатые кристаллы трихлороэтиленплатината(II) калия, называемые солью Цейзе. При обработке цис-диамминдихлороплатины(II) пиримидинами, тимином или урацилом возникает интенсивное синее окрашивание. Образующиеся платиновые сини содержат цепи различной длины, в которых атомы платины находятся в степенях окисления +2, +3, +4.
Ацетилацетонаты платины и палладия M(acac)2 получают действием ацетилацетона на хлоридные комплексы в присутствии щелочи. Оба вещества представляют собой типичные для этих элементов плоско-квадратные комплексы с двумя хелатирующими О-донорными дикетонатными группами.
Палладий(II) и платина(II) являются мягкими кислотами Пирсона, поэтому при взаимодействии с лигандами, содержащими различные донорные атомы, всегда отдают предпочтение более мягкому донорному центру. Так, с нитрит-ионом образуется нитро-изомер [Pt(NO2)4]2–, координированный через азот, в сульфитном комплексе [Pd(SO3)4]6– атом палладия координирован атомами серы, а не кислорода, как в большинстве сульфитных комплексов других металлов, а в дикетонатном комплексе [Pt(acac)2Cl]– один из ацетилацетонатных дигандов образует σ-связь с платиной через атом углерода:
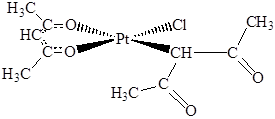
ДОПОЛНЕНИЕ. Вакер-процесс.
Ацетальдегид и получаемая его окислением уксусная кислота представляют собой одни из важнейших продуктов основного органического синтеза. Долгое время промышленный синтез ацетальдегида был основан на реакции Кучерова – гидратации ацетилена в присутствии солей ртути. Разработанный и внедренный в 1960-е г.г. компаниями Waker-Chemie и Farbwerke Hoechst процесс получения ацетальдегида прямым окислением этилена за короткое время вытеснил прежний метод. Вакер-процесс основан на реакции окисления этилена дихлоридом палладия:
CH2=CH2 + PdCl2 + H2O = CH3CHO + Pd + 2HCl.
Выделяющийся палладий регенерируют введением хлорида меди(II)
Pd + 2CuCl2 = PdCl2 + 2CuCl,
который регенерируют путем окисления кислородом:
2CuCl + 2HCl + 1/2O2 = 2CuCl2 + H2O.
Таким образом, суммарно реакцию можно представить в виде
CH2=CH2 + 1/2O2 = CH3CHO.
Процесс осуществляют в титановых реакторах путем жидкофазного окисления этилена кислородом воздуха в растворе, содержащем хлориды меди и палладия.
Механизм протекающих при этом реакций (Рис.6.57. Механизм Вакер-процесса) являлся предметом тщательного изучения. В растворе, содержащем хлориды меди, палладия и соляную кислоту, всегда присутствует некоторое количество тетрахлоропаллада(II). На первой стадии один из атомов хлора в [PdCl4]2– замещается на молекулу этилена, при этом образуется комплекс аналогичный соли Цейзе. Дальнейший ход процесса предполагает замещение хлора в транс-положении к этилену (стадия 2), так как этилен обладает более сильным транс-влиянием, чем хлорид. На третьей стадии процесса координированная молекула этилена подвергается атаке молекулы воды, что приводит к образованию оксиэтильной группы (–CH2CH2OH), связанной с атомом платины σ-связью. Внутримолекулярная перегруппировка (стадия 4) сопровождается восстановлением палладия и образованием протонированной формы ацетальдегида.
КОНЕЦ ДОПОЛНЕНИЯ
Соединения в высших степенях окисления.
Высокая устойчивость никеля(II) делает возможным синтез соединений никеля в более высоких степенях окисления лишь под действием сильных окислителей – брома в щелочной среде, гипохлорита, электролитического тока. При действии брома на щелочные растворы солей никеля(II) при комнатной температуре образуется черный осадок оксогидроксида NiOOH:
2NiSO4 + 6NaOH + Br2 = 2NiOOH¯ + 2NaBr + 2Na2SO4 + 2H2O.
При хранении или при слабом нагревании он превращается в черные смешанные оксогидроксиды никеля(II, III) 2NiOOH×Ni(OH)2 или NiOOH×NiO (Greaves C., Malsbury A.M., Thomas M.A., Solid State Ionics, 1986, 18, 763; Journ. Solid State Chem., 1987, 71, 418). Дальнейшее нагревание приводит к оксиду Ni3O4. Эти вещества разлагаются кислотами:
2NiOOH + 6HCl = 2NiCl2 + Cl2 + 4H2O,
4NiOOH + 8HNO3 = 4Ni(NO3)2 + O2 + 6H2O.
Взаимные превращения гидроксидов никеля(III) и никеля(II) используют в создании щелочных и металл-гидридных аккумуляторов.
Окисление оксида никеля(II) пероксидами или кислородом в щелочной среде приводит к никелатам(III) (NaNiO2, Na5NiO4) или смешанным фазам, содержащим атомы никеля в разных степенях окисления от +2 до +4 (K3Ni2O4, K9Ni2O7, BaNi4O8). Известны также и никелаты(IV), например, BaNiO3. Все эти соединения при попадании в воду или растворы кислот восстанавливаются с выделением кислорода.
Окисление растворов солей никеля(II) избытком гипохлорита или персульфатом приводит к черному осадку примерного состава NiO2×xH2O. Электрохимическим окислением никеля в ратсворе гидроксида натрия была получена кристаллическая фаза NaNi+3Ni2+4O6(H2O)6 (Bartl H., Bode H., et al., Electrochim. Acta,1971, 16, 615).
Соли никеля в степенях окисления +3 и +4 неизвестны, однако окраску гипотетического катиона [Ni(H2O)6]4+ можно представить по гетерополисоединению (NH4)6(NiMo9O32)×6.5H2O, имеющему темно-красный цвет. Оно образуется при окислении ионов никеля(II) персульфатом аммония в присутствии гептамолибдата. Известен также и периодат NH4NiIO6 (MT. Weller, et al, Journ. Chem. Soc., Dalton Trans., 1994, 1483), а для никеля(III) оксоацетат, типичный для трехзарядных катионов.
Высшие степени окисления никеля удается стабилизировать в комплексных соединениях. Особое внимание изучению комплексов никеля(III) стали уделять в последние годы после того, как было обнаружено, что никель содержится в некоторых ферментах (уреазе, гидрогеназе, СО-дегидрогеназе, метил-кофермент М редуктазе), действие которых основано на изменении степени окисления металла от +1 до +3. В комплексах никель(III) имеет электронную конфигурацию d7, то есть относится к ян-теллеровским ионам. Поэтому неудивительно, что в в октаэдрических комплексах [NiF6]3– и [Ni(dipy)3]3+ обнаружено тетрагональное искажение. Синтезированы комплексы никеля(III) с макроциклическими лигандами, комплексонами, фосфинами, дипиридилом и фенантролином. Комплексы никеля(IV) получены с полиселенидами, карборанами и диоксимом диацетилпиридина (S. Mandal, E.S: Gould, Inorg. Chem., 1995, 34, 3993). Все эти соединения являются сильными окислителями и легко восстанавливаются до никеля(II).
ДОПОЛНЕНИЕ. Щелочные аккумуляторы.
Наибольшее распространение получили никель-кадмиевые аккумуляторы, принцип действия которых основан на обратимом процессе:
разряд
2NiOOH + Cd + 2H2O  2Ni(OH)2 + Cd(OH)2 , E° = 1.30 B
2Ni(OH)2 + Cd(OH)2 , E° = 1.30 B
заряд
Никелевый электрод представляет собой пасту гидроксида никеля, смешанную с проводящим материалом и нанесенную на стальную сетку, а кадмиевый электрод – стальную сетку с впрессованным в нее губчатым кадмием (Рис.6.58. Никель-кадмиевый аккумулятор). Пространство между электродами заполнено желеобразным составом на основе влажной щелочи, который замерзает при –27 оС. Индивидуальные ячейки собирают в батареи, обладающие удельной энергией 20-35 Вт.час/кг и имеющие большой ресурс – несколько тысяч зарядно-разрядных циклов. Они компактны и просты в обращении, однако в связи с токсичностью соединений кадмия их использование в настоящее время резко ограничивается.
Кадмий в никелевом аккумуляторе может быть заменен на железо:
разряд
2NiOOH + Fe + 2H2O  2Ni(OH)2 + Fe(OH)2 , E° = 1.37 B
2Ni(OH)2 + Fe(OH)2 , E° = 1.37 B
заряд
Эти аккумуляторы дешевле никель-кадмиевых, обладают удельной энергией 20-35 Вт.час/кг, но отличаются повышенным саморазрядом из-за коррозии железа и пониженными отдачами по току и энергии.
Никель-водородные аккумуляторы состоят из твердого никелевого электрода и газообразного водорода. Токообразующая реакция в ячейке:
NiООН + 1/2Н2  Ni(ОН)2 .
Ni(ОН)2 .
При заряде Ni(OH)2 превращается в NiOOH, и на поверхности водородного электрода выделяется Н2. При разряде затрачивается то же самое количество водорода, и NiООН восстанавливается с выделением электрической энергии. Электролитом служит 30-35 %-ый раствор гидроксида калия с добавками гидроксида лития. Рабочее давление водорода в ячейке требует тщательной герметизации контейнера.
Использование платиновой черни в электродах резко удорожает конструкцию ячеек, благодаря чему они используются только в специальных целях – там, где требуется обеспечить длительную стабильную работу, например, в космических аппаратах. Рабочая ячейка обеспечивает удельную энергию 55-66 Вт.час/кг.
Для понижения давления водорода в ячейке газообразный водород заменяют гидридами переходных металлов, например, интерметаллидом LaNi5, поглощающим до одного атома водорода на один атом металла. Однако при повторении циклов гидриды постепенно дезактивируются и теряют способность поглощать водород из-за взаимодействия с кислородом и парами воды, находящимися внутри ячейки.
При заряде водород входит в решетку гидрида, а при разряде покидает гидрид для участия в реакции:
Ni(OH)2 + M  NiOOH + MH.
NiOOH + MH.
Емкость гидридных ячеек на 30-50 % больше, чем у никель-кадмиевых аккумуляторов. Они выдерживают 200-500 циклов заряда-разряда и используются в автомобильных двигателях.
КОНЕЦ ДОПОЛНЕНИЯ
Окисление соединений платины(II) и палладия(II) представляет собой двухэлектронный процесс, приводящий к степени окисления +4, минуя промежуточную. В целом устойчивость этой степени окисления возрастает вниз по группе: известны единичные комплексы никеля(IV), более обширна химия палладия и особенно платины. Соединения палладия(IV) являются сильными окислителями и легко подвергаются восстановительному элиминированию. Электронная конфигурация d6 обусловливает образование низкоспиновых октаэдрических комплексов. Палладий(IV) и платина(IV) являются более жесткими кислотами по сравнению с ионами палладия(II) и платины(II), о чем свидетельствует уменьшение устойчивости галогенидных комплексов [MX6]2– в ряду I–Br–Cl–F.
Окисление нитрата палладия(II) оксидом азота N2O4 приводит к образованию нитрата Pd(NO3)4, другие простые соли палладия(IV) неизвестны (Сноска: Имеется сообщение о том, что при выпаривании раствора, полученного взаимодействием палладия с концентрированной азотной кислотой, выделен гидроксонитрат [Pd(NO3)2(OH)2] (C.C. Addison, B.G. Ward, Chem. Commun., 1966, 155). В то же время, кристаллы, выпадающие при охлаждении раствора, согласно данным структурного анализа, представляют собой Pd(NO3)2(H2O)2, см. рис.6.51). Окисление тетрахлоропалладата(II) хлором при комнатной температуре или растворение палладия на холоду в царской водке приводит к ярко-красным гексахлоропалладатам, например, K2[PdCl6]. Эта соль является сильным окислителем, уже при кипячении водного раствора она выделяет хлор, превращаясь обратно в K2[PdCl4]. Твердое вещество выдерживает нагревание до 150 °C. Аналогичные комплексы получены и с другими галогенами, гексафторопалладаты, как и нитрат, в водных растворах нацело гидролизуются, давая темно-красный осадок диоксида:
K2[PdF6] + (n + 2)H2O = PdO2×nH2O¯ + 2KCl + 4HF.
Растворение его в кислотах обычно сопровождается окислительно-восстановительной реакцией, со щелочами он дает гексагидроксопалладаты(IV) [Pd(OH)6]2–.
Окислением комплексов палалдия(II) хлором, азотной кислотой или персульфатом можно получить и другие соединения палладия(IV):
K2[PdCl4] + (NH4)2S2O8 + 6KCN = K2[Pd(CN)6] + 2K2SO4 + 2NH4Cl + 2KCl.
Все они являются сильными окислителями, а при нагревании отщепляют два лиганда, восстанавливаясь до соединений палладия(II).
Соединения платины(IV) более устойчивы, чем соединения палладия(IV) и никеля(IV). Из них наиболее известны гексахлороплатинаты(IV) – соли платинохлористоводородной кислоты, образующейся при растворении платины в царской водке. При выпаривании раствора может быть получена и сама кислота в виде оранжево-желтых призматических кристаллов (H3O)2[PtCl6]×2H2O. Растворимость гексахлороплатинатов(IV) щелочных металлов понижается с ростом размера катиона: хорошо растворимы в воде лишь литиевая и натриевая соли. Платинохлористоводородная кислота является сильной, поэтому ее соли практически не гидролизуются. Калийная соль имеет структуру, в которой октаэдры [PtCl6]2– образуют трехслойную плотнейшую упаковку, а катионы К+ занимают тетраэдрические пустоты (Рис.6.59 (а); Рис.6.59. Структура соединений платины(IV) (а) К2[PtCl6], (б) Н2[Pt(ОН)6]). (Сноска: Это структура типа флюорита CaF2, в которой катионы и анионы поменялись местами, поэтому ее принято называть антифлюоритом). Гексахлороплатинат(IV) аммония при нагревании разлагается
600 °C
3(NH4)2[PtCl6] ¾¾¾® 3Pt + 18HCl + 2NH3 + 2N2.
Нагревая асбест, пропитанный раствором этой соли, получают платинированный асбест, используемый в качестве катализатора.
Светло-желтый осадок гидратированного оксида PtO2×4H2O получают, действуя на гексахлороплатинат(IV) натрия избытком щелочи, нагревая раствор до кипения, а затем прибавляя к нему уксусную кислоту. Изучение кристаллической структуры осадка показало, что он состоит из октаэров [Pt(OH)6], связанных между собой водородными связями с участием ионов водорода (Рис.6.59 б). Таким образом, состав вещества правильно записывать в форме гидроксокомплекса H2[Pt(OH)6] (Bandel G., Platte C., Troemel M., Z. Anorg. Allg. Chem., 1981, 472, 95). Он является амфотерным основанием, растворяясь в избытке щелочи с образованием гексагидроксоплатинатов(IV), например, Na2[Pt(OH)6]. Соляная кислота переводит его в платинохлористоводородную кислоту. При нагревании гидратированный оксид частично обезвоживается, при этом в результате старения усиливается его окраска, а реакционная способность по отношению к кислотам и щелочам снижается.
Сплавлением платинохлористоводородной кислоты с нитратом натрия при 550 °C и последующим выщелачиванием плава водой получают коричневый порошок примерного состава PtO2×H2O, представляющий собой не индивидуальное вещество, а смесь. Под названием катализатор Адамса его используют для гидрирования олефинов и карбонильных соединений.
Термическое разложение гексагидрокоплатинатов(IV) приводит к платинатам, например, Na2PtO3, CaPtO3. Они могут быть получены также и спеканием PtO2 с оксидами металлов.
Из простых солей платины(IV) известен лишь фторсульфонат Pt(SO3F)4 – темно-коричневый порошок, образующийся при растворении платины в смеси фторсульновой кислоты HSO3F и фторангидрида пероксодисерной кислоты FO2S–O–O–SO2F (KC. Lee, F.A. Aubke, Canad. Journ. Chem., 1979, 57, 2058). Нитрат платины(IV) в литературе не описан, однако имеются сообщения, что из растворов H2[Pt(OH)6] в концентрированной азотной кислоте при добавлении ионов калия кристаллизуется K2[Pt(NO3)4(OH)2].
В отличие от хлоридных комплексов палладия(IV), гексахлороплатинаты(IV) более устойчивы при нагревании и в кислой среде проявляют окислительные свойства только под действием сильных восстановителей, например, гидразина, хлорида олова(II) или муравьиной кислоты:
2H2[PtCl6] + N2H6Cl2 ¾® 2H2[PtCl4] + N2 + 6HCl,
2H2[PtCl6] + 2HCOOH ¾® Pt + 2СО2 + 8HCl + 2Cl2.
В щелочной среде многие восстановители (цинк, формальдегид, глицерин, соли железа(II), гидразин) особенно в горячих растворах способны восстанавливать гексахлороплатинаты до металла, который выделяется в виде мельчайшего черного порошка (черни):
Na2[PtCl6] + CH2O + 4NaOH ¾® 6NaCl + CO2 + Pt¯ + 3H2O.
При пропускании угарного газа через раствор платинохлористоводородной кислоты, содержащий избыток ацетата натрия, образуется коллоидный раствор платины красного цвета:
H2[PtCl6] + 2CO + 6CH3COONa + 2H2O ¾® 6NaCl + 6CH3COOH + 2CO2 + Pt¯.
В присутствии каталитических количеств хлоридных комплексов платины(II) они способны хлорировать некоторые органические соединения:
H2[PtCl6] + CH3COOH ¾® H2[PtCl4] + ClCH2COOH + HCl.
Эта реакция служит примером автокаталитического процесса.
Общими методами синтеза комплексных соединений платины(IV) являются окисление комплексов платины(II):

или реакции замещения

Координированные молекулы аммиака активируются атомом платины, благодаря чему приобретают способность образовывать производные с карбонильными соединениями, например, диимин ацетилацетона (I.P. Evans, G.W. Everett, A.M. Sargeson, Journ. Amer. Chem. Soc., 1976, 98, 804).
Подобно никелю, палладий(IV) и платина(IV) могут быть стабилизированы в иодатных, периодатных и теллуратных комплексах, например, K2[Pt(IO3)6], K3H3[Pt(IO6)2], Na5H3[Pd(TeO6)2]. Дикетонаты платины и палладия(IV) не могут быть получены действием лиганда на гексахлороплатинат(IV) из-за окисления дикетона, поэтому бис-комплексы получают окислительным присоединением:
Pt(acac)2 + I2 = транс-Pt(acac)2I2.
Большинство комплексов платины и палладия, которые формально соответствуют степени окисления +3, на самом деле содержат атомы металлов в двух степенях окисления: +2 и +4. Примером является соединение Pt(NH3)2Cl3, в структуре которого чередуются слои октаэдрических [Pt(NH3)2Cl4] и квадратных комплексов [Pt(NH3)2Cl2]. Атомы хлора, находящиеся в транс-положении в вершинах октаэдров, связывают их в линейную цепь. Благодаря частичному перекрыванию протяженных dz2-орбиталей атомов платины, вещество является проводником электрического тока, но только в направлении расположения цепей (Рис. Цепи из октаэдров [Pt(NH3)2Cl4] и квадратов [Pt(NH3)2Cl2] в комплексе Pt(NH3)2Cl3 (а) и возникновение электрической проводимости при перекрывании dz2-орбиталей (б)). Еще лучшей проводимостью обладают комплексы, полученные окислением части атомов платины в [Pt(CN)4]2– , например, K2[Pt(CN)4Br0.3] (R.J.H. Clark, Journ. Chem. Soc., Dalton Trans., 1983, 141; R.J.H. Clark, Chem. Soc. Rev., 1990, 19, 107). Большинство истинных комплексов платины(III) представляют собой димеры с одинарной связью металл-металл, например, [Pt2(μ2-OAc)4(H2O)2]2+, образующийся при окислении K2[Pt(NO2)4] хлорной кислотой в ледяной уксусной кислоте (T.G. Appleton, et al, Journ. Amer. Chem. Soc., 1992, 114, 7305) и K2[Pt2(μ2-SO4)4(H2O)2], полученный взаимодействием [Pt(NO2)2(NH3)2] с серной кислотой. Темно-красные кристаллы Pt2(HSO4)2(SO4)2, полученные взаимодействием платины с концентрированной серной кислотой в запаянной ампуле при 350 °C в течение трех дней, также состоят из катионов Pt26+ (Pt-Pt 0.247 нм), координированных η2-мостиковыми сульфатными и гидроксульфатными группами (Рис.6.61 Строение Pt2(HSO4)2(SO4)2 ) (M Pley, M.S. Wickleder, Z. Anorg. Allg. Chem., 2004, 630, 1036).
Из соединений платины и палладия в высших степенях окисления надежно охарактеризованы лишь гексафтороплатинаты(V) и гексафторопалладаты(V), известные как в виде солей щелочных металлов (Na+[МF6]–, M = Pd, Pt), так и в виде производных оксигенила O2+[MF6]–. Желто-оранжевые кристаллы O2+[PtF6]– – образуются при окислении платины смесью фтора и кислорода. Они летучи, разлагаются водой на гексафтороплатинат(IV), небольшое количество гидратированного диоксида платины и кислород, содержащий примесь озона. Замещение катиона оксигенила на щелочной металл проводят, добавляя соответствующий фторид к раствору в пентафториде иода:
IF5
O2+[PtF6]– + NaF ¾¾¾® Na+[PtF6]– + 1/2O2
При сильном нагревании соль оксигенила разлагается на простые вещества.
Имеется сообщение об образовании серо-зеленого вещества состава K2Pt3O10 при электрохимическом окислении гидратированного диоксида платины в щелочной среде. При обработке этой соли уксусной кислотой получен оранжево-красный порошок примерного состава PtO3. Его строение и точный состав неизвестны, однако, основываясь на его способности выделять хлор из соляной кислоты, можно предположить наличие в нем платины в высокой степени окисления.
Дата добавления: 2016-01-03; просмотров: 3265;
