Кондуктометрический анализ
Краткие теоретические сведения.Первичный аналитический сигнал в кондуктометрии – электрическое сопротивление раствора R, равное 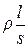 . В этой формуле r – удельное сопротивление, l – расстояние между электродами, S – площадь электрода. Отношение
. В этой формуле r – удельное сопротивление, l – расстояние между электродами, S – площадь электрода. Отношение 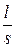 , постоянное для данной измерительной ячейки, называется константой ячейки и обозначается символом К. Сопротивление раствора обычно является первичным аналитическим сигналом, но пользоваться им для аналитических целей неудобно – сопротивление падает, причем нелинейно, при увеличении концентрации, а также зависит от устройства измерительной ячейки, то есть от константы ячейки. Вторичный аналитический сигнал c=
, постоянное для данной измерительной ячейки, называется константой ячейки и обозначается символом К. Сопротивление раствора обычно является первичным аналитическим сигналом, но пользоваться им для аналитических целей неудобно – сопротивление падает, причем нелинейно, при увеличении концентрации, а также зависит от устройства измерительной ячейки, то есть от константы ячейки. Вторичный аналитический сигнал c= 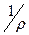 называют электропроводностью раствора [9]. Правильнее называть ее удельной электропроводностью [2]. Эту величину удобно рассчитывать по формуле c= K / R, важно, что электропроводность данного раствора, измеренная в разных ячейках, оказывается одной и той же. Удельная электропроводность имеет размерность См ×м–1, т.е. измеряется в сименсах (обратные омы) на метр. Именно электропроводность линейно зависит от концентрации определяемого вещества в растворе. Для раствора любого сильного электролита в отсутствие посторонних веществ выполняется соотношение c = kC. Угловой коэффициент градуировочного графика k (чувствительность измерения сигнала) зависит в основном от природы растворенного электролита, а также от температуры (k увеличивается на 2,0– 2,5% при увеличении температуры на каждый градус). В некоторой степени k зависит от вязкости растворителя и интенсивности перемешивания. Приведенное выше уравнение c = kC – это основа прямой кондуктометрии. Соответствующие датчики широко распространены в технике, они удобны для непрерывного автоматического контроля содержания вещества в однокомпонентных растворах.
называют электропроводностью раствора [9]. Правильнее называть ее удельной электропроводностью [2]. Эту величину удобно рассчитывать по формуле c= K / R, важно, что электропроводность данного раствора, измеренная в разных ячейках, оказывается одной и той же. Удельная электропроводность имеет размерность См ×м–1, т.е. измеряется в сименсах (обратные омы) на метр. Именно электропроводность линейно зависит от концентрации определяемого вещества в растворе. Для раствора любого сильного электролита в отсутствие посторонних веществ выполняется соотношение c = kC. Угловой коэффициент градуировочного графика k (чувствительность измерения сигнала) зависит в основном от природы растворенного электролита, а также от температуры (k увеличивается на 2,0– 2,5% при увеличении температуры на каждый градус). В некоторой степени k зависит от вязкости растворителя и интенсивности перемешивания. Приведенное выше уравнение c = kC – это основа прямой кондуктометрии. Соответствующие датчики широко распространены в технике, они удобны для непрерывного автоматического контроля содержания вещества в однокомпонентных растворах.
Тем не менее в исследуемых растворах гораздо чаще находится не одно растворенное вещество, а несколько. Электропроводность зависит от концентраций всех электролитов, находящихся в растворе, а именно, для растворов сложного состава
c = Const × å Сi li Zi ,
где Сi – молярная концентрация i-го иона; li – подвижность i-го иона; Zi –заряд иона. Подвижности ионов – табличные характеристики, их принято относить к единице заряда. Очевидно, даже зная качественный состав раствора и используя известные значения подвижностей, нельзя найти неизвестные Ci по величине c (одно уравнение с несколькими неизвестными не имеет единственного решения). Таким образом, метод прямой кондуктометрии нельзя применять для определения состава сложных проб (смесей). Эти пробы можно проанализировать методом кондуктометрического титрования.
Если измерять li в См×м2/кг моль, то численные значения li для всех ионов в водных растворах при комнатной температуре находятся в пределах 3,0-7,0 на единицу заряда (далее размерность у li опущена). Таким образом, кондуктометрический анализ совершенно не селективен. Аномально высокой подвижностью обладают ионы лишь ионы H+ и ОН- (соответственно 35,0 и 19,9). Однако подвижности ионов в некоторой степени зависят от их концентрации. Поэтому точные значения li нельзя получить из справочников, там приведены значения li0 – подвижностей ионов в бесконечно разбавленных растворах (при m=0). В реальных растворах подвижности несколько меньше:
li » li0 – BÖm .
Так как величина В невелика [7], для предвидения хода кривых кондуктометрического титрования можно приближенно считать li = li0.
Чтобы кондуктометрически определить концентрацию i-го компонента исследуемой смеси, надо подобрать химическую реакцию, которая возможна только для этого компонента, но не для других ионов, присутствующих в том же растворе. Затем надо оттитровать раствор подходящим реагентом, многократно измеряя электропроводность в ходе титрования. Полученная в координатах c – VR кривая титрования имеет излом: до точки эквивалентности электропроводность раствора может снижаться, оставаться постоянной или несколько возрастать (судя по относительной подвижности ионов, участвующих в реакции), а за точкой эквивалентности, когда реакция уже не идет, добавляемый избыток титранта ведет к резкому возрастанию электропроводности. Конечную точку титрования (Vк.т.т.) находят по методу пересечения касательных. Считают, что Vт.экв » Vк.т.т.. Расчет результатов анализа ведут, как в обычных титриметрических методах, пользуясь нормальными концентрациями.
Кондуктометрический анализ – точный способ, удобный для исследования состава мутных, агрессивных сред; он применим и для анализа неводных растворов. К сожалению, кондуктометрическое титрование нельзя проводить в сильно разбавленных растворах (~ 10-5 моль/литр и менее), а также в присутствии большого избытка посторонних инертных электролитов. В последнем случае вклад титруемого иона Х в общую электропроводность раствора невелик по сравнению с фоном, и как бы этот вклад не менялся при титровании, изменение c за счет химической реакции оказывается при этом примерно таким же, как и погрешность измерения c. Так, методом кондуктометрического титрования легко определить содержание СО2 в дистиллированной воде, но этот способ неприменим для анализа морской или сточной воды. Присутствие же посторонних веществ молекулярного характера (неэлектролитов) кондуктометрическому анализу, как правило, не мешает; фон, создаваемый ими, очень мал.
Аппаратура. Применяемые в кондуктометрии приборы должны быстро и безошибочно определять сопротивление исследуемого раствора переменному току (возможно и непосредственное измерение электропроводности). Постоянный ток для кондуктометрии неудобен, поскольку он вызывает разложение исследуемого раствора (электролиз) и, что еще важнее, – поляризацию электродов. В этом случае сопротивление раствора зависело бы не столько от концентрации всех ионов в растворе, сколько от концентрации веществ, разряжающихся на электродах (как в полярографии). Влияние поляризации уменьшается при повышении частоты переменного тока и не сказывается вовсе, если прибор работает на частоте 1000 Гц и более. Кроме того, поляризация уменьшается при низких плотностях тока, поэтому желательны ячейки с плоскими инертными (Pt) электродами, расположенными параллельно друг другу. Для измерения электропроводности слабопроводящих растворов следует брать ячейки с низкими значениями К (т.е. с большими и близко расположенными электродами), а для хорошо проводящих растворов – с высокими К. Описано множество конструкций электрохимических ячеек, отличающихся расположением электродов [4; 7; 8].
При прохождении переменного тока через раствор измерение омического (активного) сопротивления осложняется влиянием индуктивности и емкости ячейки, которые зависят от концентрации иона в растворе. Эта зависимость является основой высокочастотной кондуктометрии (теория ВЧ-кондуктометрии весьма сложна [4, с.113-138] и не рассматривается в общем курсе аналитической химии). При правильном выборе ячейки и сравнительно низких частотах (50-1000 Гц) влиянием этих факторов можно пренебречь или, что лучше, компенсировать связанные с ними ошибки измерения, несколько усложняя схему измерительного прибора.
Сопротивление исследуемого раствора (Rx) измеряют с помощью приборов, включающих мостовую схему (мост Уитстона). В качестве нуль-инструмента можно применять различные гальванометры, телефоны (при работе на звуковой частотe), осциллографы и т.д.
Дата добавления: 2015-10-26; просмотров: 3083;
