Колориметрический анализ
Краткие теоретические сведения.Колориметрические методы основаны на визуальной оценке поглощения света растворами. Колориметрический анализ – небольшая составная часть спектрофотометрического анализа. Простейшие колориметрические методики появились еще в XIX веке (например, методики анализа минеральных вод), но и сегодня в агрохимическом, гидрохимическом и клиническом анализе применяют экспрессные методики, не требующие приборов и лабораторного оборудования. Колориметрические методы употребляют там, где экспрессность и низкая стоимость анализа важнее его точности. Отметим, что в современных колориметрических методиках применяют те же фотометрические реакции, что и при инструментальных методах измерения светопоглощения.
Для оценки концентрации определяемого вещества можно применять различные варианты колориметрического анализа.
1. Метод стандартной шкалы. Это самый распространенный и самый быстрый из всех колориметрических методов. В нем видимую окраску исследуемого раствора сопоставляют в одинаковых цилиндрах или пробирках с серией окрашенных растворов того же состава, но с известным содержанием определяемого вещества Х. Иногда вначале используют шкалус сильно отличающимися концентрациями (грубое определение), а затем, выяснив, между какими стандартными растворами оказалась концентрация Х в исследуемом растворе, готовят новую, более подробную шкалу именно для этого интервала концентраций и затем уточняют по ней результат анализа. Метод стандартной шкалы не требует выполнения закона Бера (в отличие от метода уравнивания) и дает погрешность порядка 30% отн.
Так как человеческий глаз значительно лучше отличает оттенки цветов, чем изменения в интенсивности одного и того же цвета, то метод стандартной шкалы дает лучшие результаты в тех случаях, когда растворы, образующие стандартную шкалу, отличаются по цвету. Например, органический реагент дитизон в отсутствие переходных металлов имеет чисто зеленую окраску, комплекс дитизона с цинком – красную, а растворы стандартной шкалы, содержащие разные количества цинка и одинаковое количество дитизона, взятого в избытке, дают все возможные промежуточные окраски между зеленой и красной. В подобных случаях определение концентрации металлов по стандартной шкале не уступает по точности многим инструментальным методам (погрешность порядка 10%).
2. Колориметрическое титрование. При таком «титровании» никаких химических реакций не происходит, название условно. Метод заключается в том, что из исследуемой пробы готовят окрашенный раствор и наливают его в некоторый сосуд, а в другой такой же сосуд с чистым растворителем понемногу добавляют стандартный окрашенный раствор Х с известной концентрацией (большей, чем в пробе) до тех пор, пока окраски растворов на глаз не сравняются. Поскольку толщина поглощающего слоя одинакова, считают, что после уравнивания окрасок концентрация Х в обоих растворах также одинакова. По затраченному объему стандартного раствора рассчитывают, сколько определяемого вещества содержалось в пробе.
3. Метод разбавления. В этом методе также готовят исследуемый и стандартный окрашенные растворы, а затем тот, что интенсивнее окрашен, разбавляют чистым растворителем до тех пор, пока (при одинаковой толщине слоя раствора!) их видимые окраски не сравняются. Зная степень разбавления, рассчитывают концентрацию исследуемого раствора.
4. Метод уравнивания. Одинаковой интенсивности поглощения света исследуемым и стандартным растворами здесь добиваются, изменяя толщину поглощающего слоя. Это можно сделать в специальном приборе – колориметре погружения или просто в паре цилиндров, если смотреть на них сверху. Если химический состав обоих растворов одинаков, закон Бера выполняется, а видимые окраски (а значит, и оптические плотности растворов) одинаковы, можно записать:
Dст = e lст Сст Dх= e lх Сх Сх= Сст lст / lx
Метод уравнивания более точен, чем другие колориметрические методы, и позволяет найти концентрацию Сх с погрешностью 10-20%.
В данной работе описаны методики анализа природных вод на содержание различных токсичных веществ, причем во всех случаях рекомендуется метод стандартной шкалы. Однако по указанию преподавателя анализ можно провести другим визуальным методом. Рассмотрим свойства некоторых токсичных веществ, которые можно определять в природных водах колориметрическим методом, а также реакции образования из них окрашенных соединений. Именно эти реакции необходимо будет проводить в ходе лабораторной работы.
Определение фенолов.Фенолы – ароматические соединения с одной или несколькими гидроксильными группами, непосредственно связанными с ароматическим ядром, например бензольным кольцом. Они попадают в окружающую среду из стоков промышленных предприятий, особенно коксохимических и нефтеперерабатывающих. Фенолы обладают сильным биологическим действием. При концентрации фенолов 0,50 мг/л в речной воде погибает рыба. В питьевой воде в РФ предельно допустимая концентрации фенолов установлена на уровне 0,001 мг/л [15-16] (в пересчете на простейший фенол C6H5OH). Содержание фенолов в питьевой воде, природных и сточных водах контролируется лабораториями санитарной службы и других организаций. Для определения фенолов применяют различные способы перевода их в окрашенные соединения; выбор метода анализа зависит от концентрации фенола в исследуемой воде и наличия мешающих веществ. Иногда в ходе анализа сумму фенолов отделяют от нелетучих мешающих веществ, отгоняя фенолы из исследуемой пробы с водяным паром, в данной работе этого не требуется. Если концентрация фенолов ожидается на уровне 0,05-50 мг/л (сильно загрязненные воды), то анализ проводят по методу Грисса, используя реакцию с пара-нитроанилином. Этот реагент заранее (в день анализа) диазотируют нитритом натрия, а потом проводят реакцию азосочетания с фенолом:


+ 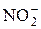 + 2H+ ® + 2H2O
+ 2H+ ® + 2H2O
 |  |
+ ® + 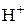
Получившийся азокраситель имеет интенсивную желто-бурую окраску. Концентрация красителя будет пропорциональна концентрации фенола в воде в том случае, если другие реагенты (нитрит, п-нитроанилин) взяты в большом и одинаковом избытке. Определение неселективно: разные фенолы дают близкие по свойствам окрашенные продукты. Выход продуктов сильно зависит от pH. Диазотирование ведут в кислой, а азосочетание – в щелочной среде.
При выполнении работы учтите, что фенолы и п-нитроанилин токсичны. Обращаться с осторожностью!
Определение нитритов.Наличие повышенной концентрации нитритов в природных водах свидетельствует о загрязнении их хозяйственными стоками. Содержание нитритов в природных водах колеблется от нескольких мкг до десятых долей мг в 1 л (нитриты менее токсичны, чем фенолы, ПДК – 1 мг/л). Для определения нитритов наиболее часто применяется колориметрический метод, основанный на реакции нитритов с сульфаниловой кислотой и a-нафтиламином (реакция Грисса-Илосвая). Вначале присутствующие нитриты реагируют с сульфаниловой кислотой (реакция диазотирования), затем диазотированная сульфаниловая кислота реагирует с a-нафтиламином (реакция азосочетания), при этом образуется красно-фиолетовый краситель:
 |  |
 +
+ 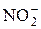 +
+ 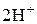 ® +
® + 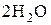


+ ® + 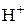
Поскольку оба реагента вводят в большом избытке по сравнению с нитритами, то концентрация красителя и оптическая плотность его раствора зависят только от концентрации нитритов. Закон Бера, как правило, хорошо выполняется. Предел обнаружения нитритов без дополнительного концентрирования – 1 мг/л. Мешают сильные окислители и восстановители.
Определение хлора.Содержание «активного хлора» определяют в ходе анализа хлорированной водопроводной воды. Растворенный хлор определяют и в некоторых сточных водах, ПДКСl = 0,4 мг/л. Кроме молекул Cl2, в понятие «активного хлора» входят и ряд других неустойчивых соединений хлора, образующихся при хлорировании воды, например, гипохлориты, хлорамины и т. д. Все эти соединения реагируют подобно свободному хлору и определяются суммарно. Результат анализа выражают в пересчете на Сl2 (мг/л). Определение должно быть проведено немедленно после отбора пробы воды.
Для определения небольших количеств хлора наиболее удобен колориметрический метод с о-толуидином. Этот реагент окисляется хлором (а также другими окислителями) по не вполне изученному механизму, при этом раствор приобретает желтую или оранжевую окраску. Определению мешают железо (>0,3 мг/л) и нитриты (>0,1 мг/л). В присутствии ряда мешающих веществ определение хлора серьезно усложняется. Соответствующие методики описаны в литературе.
Поскольку стандартная шкала, содержащая окисленный о-толуидин, неустойчива при хранении, а готовить ее ежедневно заново нежелательно, в лабораториях часто пользуются устойчивой искусственной шкалой, приготовленной из растворов K2CrO4 и K2Cr2O7. Окраска стандартных растворов такой шкалы на глаз точно соответствует окраске растворов, содержащих различные известные количества продукта взаимодействия хлора с о-толуидином. Подобные искусственные шкалы в практике используют весьма часто.
Дата добавления: 2015-10-26; просмотров: 3954;
