Реакции карбонильных соединений
 Альдегиды и кетоны терпенового ряда претерпевают все характерные для данного класса органических соединений превращения. Двойная связь оксогруппы вследствие высокой электроотрицательности атома кислорода имеет полярный характер. При этом наиболее сильно смещено к атому кислорода подвижное электронное облако π-связи, благодаря чему атом углерода несет значительный положительный заряд и может атаковаться нуклеофильными агентами:
Альдегиды и кетоны терпенового ряда претерпевают все характерные для данного класса органических соединений превращения. Двойная связь оксогруппы вследствие высокой электроотрицательности атома кислорода имеет полярный характер. При этом наиболее сильно смещено к атому кислорода подвижное электронное облако π-связи, благодаря чему атом углерода несет значительный положительный заряд и может атаковаться нуклеофильными агентами:
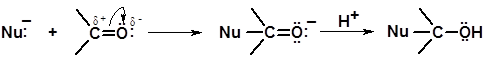
Реакции нуклеофильного присоединения (AN) являются наиболее характерными в ряду карбонильных соединений.
Карбонильная группа легко протонируется кислотами:
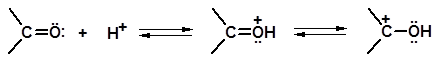
Протонирование приводит к увеличению положительного заряда на атоме углерода, что способствует повышению скорости реакций с нуклеофилами. В качестве нуклеофилов выступают спирты, производные аммиака, гидросульфит натрия, а также СН-кислоты и другие реагенты, имеющие тенденцию образовывать связь с атомом углерода за счет свободной пары электронов.
В качестве СН-кислот могут выступать также сами альдегиды и кетоны, поскольку отрицательный индукционный эффект карбонильной группы обусловливает появление свойств СН-кислот у α-звена данного класса органических соединений. Таким образом, еще одним реакционным центром карбонильных соединений, кроме оксогруппы, является α-звено углеводородной цепи при наличии в нем атомов водорода. С участием α-звена протекают характерные для оксосоединений процессы конденсации.
Многие реакции присоединения по карбонильной группе, а также реакции конденсации имеют важное практическое значение и осуществляются в промышленных масштабах.
Дата добавления: 2015-09-29; просмотров: 844;
