Лечение 5 страница
Плевральная пункция необходима для удаления гноя (в этот период, как правило, жидкой консистенции) из плевральной полости, взятия его для бактериологического исследования и последующей антибактериальной терапии, а также для введения в плевральную полость растворов антибиотиков. Пункцию выполняют в шестом—седьмом межреберье по лопаточной линии под местным обезболиванием.
Тотальный пиоторакс (эмпиема)
Тотальный пиоторакс (эмпиема) — состояние, характеризующееся наличием большого количества гнойного выпота в плевральной полости. Эмпиема развивается в тех случаях, когда не удалось купировать процесс на более ранних стадиях. У детей с эмпиемой плевры ухудшение состояния связано не только с гнойной интоксикацией, но и с дыхательной недостаточностью. При этом степень дыхательных нарушений находится в прямой зависимости от количества экссудата, выраженности коллабирования лёгкого, смещения средостения и нарушений механизма дыхания. Характерны следующие физикальные данные: значительное притупление перкуторного звука и ослабление дыхания вплоть до полного его отсутствия на стороне поражения. Перкуторно также выявляют смещение средостения в здоровую сторону. Рентгенологические симптомы подтверждают физикальные данные — тотальное затенение в грудной полости на стороне поражения (гемиторакс) и смещение средостения в противоположную сторону (рис. 4-32). Межрёберные промежутки могут быть расширены из-за увеличения объёма плевральной полости. При эм

пиеме плевры применяют метод повторных плевральных пункций с целью эвакуации гноя и санации плевральной полости.
В запущенных случаях по мере подавления микрофлоры в плевральной полости скапливается фибрин, забивающий просвет иглы, вследствие чего пункции становятся неэффективными. В таких случаях обычно применяют дренирование плевральной полости по Бю-лау. Особенно эффективна в этих случаях торакоскопическая санация плевральной полости.
Пиопневмоторакс
Пиопневмоторакс — самое частое и тяжёлое осложнение деструктивной пневмонии. При распаде паренхимы во время образования гнойника возникает несостоятельность висцеральной плевры, и в плевральную полость опорожняется содержимое абсцесса. Мелкие бронхи в полости абсцесса лишены хрящевого каркаса и в зоне воспаления теряют тонус, в результате чего воздух проходит на периферию и не поступает в сторону бронхиального дерева. Возникает клапанный механизм с образованием напряжённого пиопневмоторакса.
Ненапряжённый пиопневмоторакс в остром периоде выявляют гораздо реже; он возникает вследствие одномоментного попадания воздуха в плевральную полость с последующим заполнением полости абсцесса фибрином и её облитерацией (рис. 4-33).
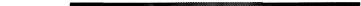
Тяжесть состояния больных с напряжённым пиопневмотораксом обусловлена главным образом интоксикацией, дыхательной и сердечно-сосудистой недостаточностью. Интоксикация в этот период нарастает за счёт накопления гнойного экссудата в плевральной полости. Внезапное ухудшение состояния у этих больных связано с выключением из дыхания лёгкого за счёт коллабирования его воздухом и частичного коллапса противоположного лёгкого за счёт смещения средостения (рис. 4-34). Последний факт объясняет механизм возникновения нарушений кровообращения. Чем младше ребёнок, тем более подвержены смещению его органы средостения, поэтому у детей младшей возрастной группы смещение сердца и крупных сосудов, а также сдавление последних приводят к резкому ухудшению состояния.
Клиническая картина при этом осложнении весьма характерна: беспокойство, выраженная одышка, тахикардия, цианоз слизистых оболочек и носогубного треугольника, нередко цианоз кожных покровов. При осмотре ребёнка обращает на себя внимание асимметрия дыхания, возникающая за счёт более или менее выраженного вздутия грудной клетки на стороне поражения. Перкуторный звук в верхних отделах коробочный, в нижних возникает его притупление от уровня жидкости и ниже. Перкуторно также оценивают степень
смещения средостения в сторону, противоположную поражению. При аускультации находят полное отсутствие дыхания с поражённой стороны, а с противоположной оно становится жёстким. Могут быть средне- и крупнопузырчатые влажные хрипы. При выслушивании сердца определяются тахикардия, нередко приглушение тонов. У детей младшего возраста часто возникает вздутие живота, что свидетельствует о парезе кишечника и оказывает существенное влияние на выраженность дыхательной недостаточности, так как уменьшает степень участия диафрагмы в акте дыхания.
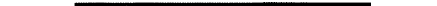
Рентгенологическое исследование, выполненное в вертикальном положении больного, позволяет выявить главный симптом пиопнев-моторакса — наличие уровня жидкости в плевральной полости. Этот симптом указывает на наличие границы двух сред (воздуха и жидкости); он может отсутствовать, если рентгенография выполнена в горизонтальном положении. Размеры и локализация уровня зависят от количественного соотношения воздуха и жидкости. Например,
уровень может быть едва заметен при скоплении малого количества гноя в рёберно-диафрагмальном синусе, однако и в этом случае речь идёт о наличии пиопневмоторакса. Лёгкое чаще всего на рентгенограмме не определяется, так как оно в большинстве случаев полностью коллабируется и как бы распластывается в области корня, будучи сдавлено воздухом. Если лёгкое инфильтрировано, оно сдавливается в меньшей степени, и рядом с корнем можно видеть наружную его тень. Кроме того, отчётливо определяется смещение средостения в противоположную сторону.
Лечение. Тяжесть состояния больных с напряжённым пиопнев-мотораксом в значительной мере определяет экстренность применения специальных методов лечения при этом осложнении. Так, первостепенную роль играет ликвидация внутригрудного напряжения с целью уменьшения дыхательной и сердечно-сосудистой недостаточности. Если такое осложнение возникло не в условиях специализированного стационара, для транспортировки ребёнка в качестве временной меры необходимо перевести закрытый напряжённый пиопневмоторакс в открытый ненапряжённый. С этой целью можно использовать так называемый игольчатый дренаж (игла с большим диаметром просвета). Пункцию производят в третьем—четвёртом межреберье по передней подмышечной линии, придают игле положение с наклоном канюли книзу и закрепляют её лейкопластырем.
Основная задача хирурга в специализированном стационаре при лечении пиопневмоторакса — в максимально ранние сроки расправить лёгкое. С этой целью проводят дренирование плевральной полости. Пассивный дренаж по Бюлау позволяет удалить гной из плевральной полости и снять внутригрудное напряжение. Однако при постоянном поддувании воздуха через бронхиальные свищи добиться расправления лёгкого не удаётся. При дренировании с активной аспирацией (к дренажу подсоединяют электровакуумный или водоструйный отсос) в плевральной полости возникает отрицательное давление, что способствует расправлению лёгкого.
Хронические формы
Успех лечения в значительной мере зависит от характера микрофлоры и иммунного статуса ребёнка, однако основополагающие моменты — своевременная диагностика, рациональная антибактериальная терапия и правильный выбор хирургических методов лечения на различных этапах развития процесса. В противном случае возможно
возникновение хронических форм поражения лёгкого и плевры. При несвоевременном удалении гноя из плевральной полости при пиото-раксе плевральные листки покрываются толстым и плотным слоем фибрина. Далее происходит замещение фибрина рубцовой тканью, что клинически проявляется сближением межрёберных промежутков. Возникает сколиоз. Лёгкое, покрытое фибриновым «панцирем», не расправляется. При пиопневмотораксе в этом случае формируется постоянно функционирующий бронхиальный свищ с образованием остаточной полости, нередко с наличием свищевого хода на грудной стенке в области стояния дренажной трубки. Иногда наблюдают случаи формирования напряжённого пневмоторакса после перенесённого острого процесса. Это осложнение возникает на фоне более или менее выраженного фибриноторакса за счёт формирования незаживающих бронхиальных свищей, поддерживающих в плевральной полости давление выше атмосферного.
Лечение хронических форм деструктивной пневмонии во многом зависит от характера осложнения. В основе хирургического пособия лежит радикальная операция декортикации лёгкого, заключающаяся в удалении фибринозного мешка (плеврэктомия) с ушиванием бронхиальных свищей или резекцией лёгкого с последующим дренированием плевральной полости. Нередко возникает необходимость проведения повторных вмешательств.
В настоящее время всё реже встречают хронические формы деструктивной пневмонии. Ранняя диагностика острой деструктивной пневмонии, правильный выбор комплекса консервативных мероприятий в сочетании с хирургическими методами лечения внутрилё-гочных и плевральных осложнений позволяют добиться полного выздоровления подавляющего большинства больных, страдающих этим тяжёлым заболеванием.
4.8. Пороки развития и заболевания пищевода 4.8.1. Атрезия пищевода
Атрезия пищевода — тяжёлый порок развития, при котором верхняя часть пищевода заканчивается слепо, а нижняя часть чаще всего сообщается с трахеей. Варианты атрезии пищевода представлены на рис. 4-35. Часто атрезия пищевода сочетается с другими пороками развития — врождёнными пороками сердца, ЖКТ, мочеполовой

системы и др. В 5% случаев атрезию пищевода наблюдают при хромосомных болезнях. Частота атрезии пищевода 0,3:1000. Соотношение мужского и женского пола 1:1.
Развитие порока связано с нарушениями в ранних стадиях эмбриогенеза. Известно, что трахея и пищевод возникают из одного зачатка — головного конца передней кишки. На самых ранних стадиях трахея широко сообщается с пищеводом. Их разделение происходит на 4—5-й неделе внутриутробного развития. При несоответствии направления и скорости роста трахеи и пищевода, а также процессов вакуолизации, которую пищевод проходит вместе с другими образованиями кишечной-трубки в сроки от 20-го до 40-го дня, возможно развитие атрезии пищевода. Для анамнеза беременности типичны многоводие и угроза выкидыша в I триместре.
Клиническая картина и диагностика
Признаки атрезии пищевода отчётливо проявляются в первые часы после рождения ребёнка. Верхний слепой отрезок пищевода и носоглотка переполняются слизью, у ребёнка появляются обильные пенистые выделения изо рта. Часть слизи новорождённый аспирирует, возникают приступы цианоза. После отсасывания содержимого носоглотки цианоз вскоре появляется вновь. Очень быстро в лёгких появляются хрипы, нарастает одышка.
Диагноз уточняют путём катетеризации пищевода тонким уретральным катетером с закруглённым концом. Катетер вводят через нос.
Пройдя на глубину 6—8 см, катетер упирается в слепой конец пищевода, либо, заворачиваясь, выходит через рот ребёнка. Через катетер отсасывают слизь. Воздух, введённый в слепой конец пищевода, с шумом выделяется из носоглотки (положительный симптом элефан-та [слона]).
Учитывая огромную важность ранней диагностики атрезии (до возникновения аспирационной пневмонии), зондирование пищевода целесообразно проводить всем младенцам с синдромом дыхательных расстройств сразу после рождения.
Клиническая картина может иметь некоторые особенности в зависимости от формы атрезии. При наиболее частой форме атрезии с дистальным трахеопищеводным свищом выявляют вздутие живота, особенно в эпигастральной области. Выраженность аспирационного синдрома зависит от диаметра трахеопищеводного соустья.
Окончательный диагноз ставят после рентгенологического исследования. После введения катетера в пищевод до упора выполняют обзорную рентгенограмму органов грудной клетки и брюшной полости. При атрезии рентгеноконтрастный катетер отчётливо виден в слепом отрезке пищевода (рис. 4-36). Наличие воздуха в желудке и кишечнике указывает на свищ между трахеей и абдоминальным отрезком пищевода. При бессвищевых формах на фоне запавшего живота отмечают полное затемнение брюшной полости. У детей со свищевыми формами атрезии о длине диастаза между концами пищевода можно в какой-то степени судить по боковой рентгенограмме. Использование для диагностики рентгеноконтрастных растворов, особенно бариевой взвеси, крайне нежелательно из-за риска аспирационной пневмонии.
В 1973 г. описана ассоциация VATER, в состав которой входит атрезия пищевода. Данное название образовано от первых букв соответствующих английских терминов (Vertebral defects, Anal atresia, Tracheoesophageal fistula, Esophageal atresia, Radial dysplasy — врожденные пороки позвонков, атрезия ануса, трахеоэзофагеальный свищ или атрезия пищевода, пороки развития почек или дефекты лучевой кости). Если у ребёнка выявлены также пороки сердца (Cardiac malformations), такое сочетание пороков обозначают аббревиатурой VACTER. В этом случае прогноз чаще бывает неблагоприятным. Нередко при атрезии пищевода встречают аномалии конечностей (Limb anomalies), тогда патологию обозначают как VACTERL. Для детей с VACTERL-ассоциацией, как правило, характерны высокая атрезия пищевода, осложнённое течение заболевания и высокая летальность. При наличии у ребёнка одной из аномалий, входящих в эту ассоциа
цию, следует искать и другие. По данным разных авторов, частота ассоциации широко варьирует. Так, полная VATER-ассоциация может встречаться в 1,5% случаев среди новорождённых с атрезией пищевода, а три компонента VACTER-ассоциации — в 17,5%.
Лечение
Только раннее оперативное вмешательство может спасти жизнь ребёнку с атрезией пищевода. Уже в родильном доме необходимо начать предоперационную подготовку, включающую аспирацию содержимого рото- и носоглотки каждые 15-20 мин, оксигенотерапию, полное исключение кормления через рот. Транспортировку следует проводить в сопровождении специализированной бригады в максимально короткий срок. Общая длительность предоперационной подготовки зависит от тяжести нарушений гомеостаза и гемодинамики,
дыхательной недостаточности, степени дегидратации. При явных признаках аспирации, нарушения дыхания, а тем более при пневмонии или ателектазе лёгких необходимо как можно раньше прибегнуть к прямой ларингоскопии с катетеризацией трахеи и аспирацией содержимого из дыхательных путей. При неэффективности последней под наркозом проводят бронхоскопию или интубацию трахеи с тщательной аспирацией содержимого. Ребёнка помещают в кувез, где обеспечивают непрерывную подачу кислорода, аспирацию содержимого ротоглотки, согревание тела ребёнка. Назначают инфузионную, антибактериальную, симптоматическую терапию.
Выбор метода оперативного вмешательства зависит от формы атрезии и состояния больного. При наиболее частой форме атрезии с дистальным трахеопищеводным свищом у детей с малым операционным риском (доношенных, без сочетанных пороков жизненно важных органов и симптомов внутричерепной родовой травмы) целесообразно начинать с торакотомии и разделения трахеопищеводного свища. Если диастаз между концами пищевода не превышает 1,5— 2 см, накладывают прямой анастомоз. При большом диастазе отрезков пищевода накладывают шейную эзофагостому и гастростому по Кадеру. При несвищевых формах из-за значительного диастаза выполняют операцию гастростомии и эзофагостомии. У больных с высоким операционным риском оперативное вмешательство чаще начинают с наложения двойной гастростомы (первая — для кормления через зонд, заведённый в двенадцатиперстную кишку, вторая — для декомпрессии желудка и уменьшения аспирации). Второй этап операции выполняют после улучшения состояния, через 2-4 дня.
В послеоперационном периоде продолжают начатую интенсивную терапию. Кормление ребёнка проводят через зонд, установленный ин-траоперационно через анастомоз либо введённый в гастростому после восстановления пассажа по кишечнику. На 6—7-е сутки исследуют состоятельность анастомоза. Под контролем рентгеновского экрана через рот ребёнка вводят 1—2 мл водорастворимого контрастного вещества. Оценивают проходимость зоны анастомоза, исключают затёки контрастного вещества. При отсутствии осложнений ребёнка начинают кормить через рот. Через 2—3 нед после операции проводят контрольную фиброэзофагогастроскопию с оценкой степени проходимости зоны анастомоза, состояния кардии, симптомов эзо-фагита. При сужении анастомоза, выявляемом в 30-40% случаев, необходимо бужирование (бужи №22-24). Длительность бужирования контролируют эзофагоскопией.
В послеоперационном периоде ребёнку в течение первого года жизни необходимо постоянное диспансерное наблюдение. Возможны явления дисфагии, осложняющиеся непроходимостью в области анастомоза, что требует срочной эзофагоскопии. В связи с этим детей на первом году жизни рекомендуют кормить гомогенизированной пищевой массой. Недостаточность кардии и желудочно-пищеводный рефлюкс, нередко осложняющий послеоперационный период, клинически проявляются ночными регургитациями, повторными пневмониями, срыгиваниями; в этом случае необходима своевременная диагностика. В ближайшие 6—12 мес у детей возможна осиплость голоса в связи с операционной травмой возвратного гортанного нерва.
После эзофаго- и гастростомии детям в возрасте от 2—3 мес до 3 лет выполняют второй этап операции — пластику пищевода толстокишечным трансплантатом.
4.8.2. Врождённый трахеопищеводный свищ
Изолированный врождённый трахеопищеводный свищ относят к редким порокам развития: частота его составляет 3—4% всех аномалий пищевода. Соустье обычно располагается высоко — на уровне VII шейного или I грудного позвонка.
Диаметр свища, как правило, 2—4 мм. Обычно свищ имеет косое направление от передней стенки пищевода кверху по диагонали к мембранозной части трахеи. Трахеопищеводный свищ может быть локализован на любом уровне (от перстневидного хряща до бифуркации трахеи), но чаще отходит от нижнешейной или верхнегрудной части трахеи. В литературе существуют описания случаев, когда у больного были одновременно два и даже три свища.
Выделяют три вида трахеопищеводных свищей: узкий и длинный, короткий и широкий (встречают наиболее часто), и отсутствие разделения между пищеводом и трахеей на большом протяжении.
Клиническая картина и диагностика
Выраженность симптомов зависит от диаметра и угла впадения свища в трахею. Характерные симптомы: приступы кашля и цианоза, возникающие во время кормления, более выраженные в горизонтальном положении ребёнка. При узких и длинных свищах возможно лишь покашливание ребёнка при кормлении. При изменении
положения симптоматика уменьшается. Ребёнок часто болеет пневмонией. Наиболее яркую клиническую картину наблюдают при широких устьях, когда уже в начале кормления молоко легко проникает втра^обронхиальное дерево. Быстро развивается острый воспалительный процесс в лёгких с ателектазами.
Диагностика трахеопищеводного свища трудна, особенно при узких свищах. Комплекс исследований включает рентгенологические и инструментальные методы. Рентгенографию выполняют в горизонтальном полонии ребёнка. Через зонд, введённый в начальный отдел пищевода, под контролем рентгеноскопии вводят раствор водорастворимого контрастного вещества. Затекание его в трахею указывает на наличие свита. Информативность этого метода невелика. Большее диагностическое значение имеет трахеоскопия. Трахею осматривают на всём протяжении — от голосовой щели до бифуркации. Свищ ще-левиднойф°Рмы располагается по задней поверхности трахеи.
Дифференциальную диагностику проводят с атрезией пищевода, ахалазиейкФДии> желудочно-пищеводным рефлюксом, сужением пищевода, лисфагией, связанной с травмой голосовых связок при проведений Реанимации в родах, дисфагией центрального генеза.
Лечение
Лечение только оперативное. Предоперационная подготовка заключается в санации трахеобронхиального дерева, лечении аспирационной пневмонии. С этой целью выполняют санационную брон-хоскопию.чазначают УВЧ-терапию, антибактериальное лечение, инфузионнУ0 терапию. Полностью исключают кормление через рот. Ребёнка кор^ят через зонд, заведённый в желудок.
Операнд мобилизации, перевязки и пересечения соустья выполняют правосторонним шейным доступом, реже выполняют заднебо-ковую торакотомию. При своевременной диагностике прогноз благоприятны"
4,8.3. Ахалазия пищевода
Ахалазияпищевода — патологическое состояние, характеризующееся функциональным нарушением проходимости кардиального отдела пише^Да. С прогрессированием заболевания пищевод теряет свою двиганную активность, что приводит к его дилатации. В дет
ском возрасте заболевание встречают значительно реже, чем у взрослых. Начало заболевания у детей в среднем относят к 8—9-летнему возрасту, хотя оно возможно и у грудных детей.
Клиническая картина
Основные симптомы заболевания — дисфагия и регургитация. Эти симптомы затруднения прохождения пищи по пищеводу и рвоты неизменённой пищей возникают чаще при приёме грубой пищи, чем жидкой. Такие проявления, как чувство дискомфорта, некоторого давления за грудиной, умеренных болей в эпигастральной области или за грудиной, дети редко могут отчётливо описать, что представляет определённые диагностические трудности.
У детей младшего возраста дисфагия проявляется косвенными признаками: дети медленно едят, тщательно пережёвывают пищу, не съедают весь объём пищи, давятся во время еды. Дети старшего возраста с целью облегчения прохождения пищи прибегают к таким приёмам, как усиленное глотание (пустые глотательные движения), запивание водой и др. В связи с тем что заболевание встречают в детском возрасте довольно редко, указанные симптомы чаще связывают с психологическими проблемами, что также несколько затягивает постановку диагноза. Это в свою очередь приводит к потере массы тела у детей, а ночные аспирации содержимого пищевода способствуют развитию рецидивирующей пневмонии. Заболевание может носить перемежающийся характер, т.е. периоды ухудшения могут чередоваться с промежутками клинического благополучия.
Диагностика
Основные методы диагностики данного заболевания — рентгенологическое исследование пищевода с контрастным веществом (наиболее часто с сульфатом бария) и эзофагоскопия.
Рентгенологическое исследование
Уже при обзорной рентгеноскопии, выполняемой в вертикальном положении, можно выявить уровень жидкости в расширенном пищеводе, что свидетельствует о нарушенной его проходимости. Затем исследование дополняют приёмом взвеси сульфата бария сметано-образной консистенции. При этом контраст или совсем не поступает в желудок, или проходит в него тонкой струёй (рис. 4-37). Во время
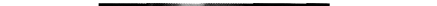 |
исследования возможно расслабление кардии с поступлением значительной порции контрастного вещества в желудок — симптом «про-валивания» — достоверный признак функционального нарушения кардии. Появление этого симптома может быть стимулировано запиванием смеси водой.
Эзофагоскопия
Эзофагоскопия — обязательное исследование, позволяющее выявить признаки эзофагита и определить степень его выраженности, а свободное проведение фиброэзофагоскопа в желудок свидетельствует об отсутствии врождённого или вторичного стеноза, связанного с рефлюкс-эзофагитом или другими причинами.
Применение манометрии в диагностике этого заболевания у Детей в настоящее время ограничено. Однако усовершенствование этого диагностического метода может позволить в дальнейшем дифференцировать ахалазию и кардиоспазм, что в свою очередь может позволить дифференцированно подходить к выбору лечебной тактики.
Дифференциальная диагностика
Ахалазию пищевода необходимо дифференцировать от врождённого стеноза пищевода, возникшего после рубцевания пептической язвы или ожога, дивертикула пищевода, а также доброкачественных и злокачественных опухолей желудка и пищевода.
Лечение
Существуют консервативные и оперативные методы лечения аха-лазии. К консервативным относят медикаментозную терапию, форсированное бужирование и кардиодилатацию (в детской практике применяют баллонную дилатацию пневмо- и гидродилататорами). При их применении наступает непосредственное улучшение, но эффект лечения нестойкий.
Наиболее распространённый вариант лечения ахалазии пищевода у детей — хирургическая коррекция. Широкое применение получила внеслизистая кардиомиотомия, сочетающаяся с эзофагокардио-фундопликацией, выполняемой при лапароскопии.
Больные с ахалазией пищевода должны находиться на диспансерном наблюдении, особенно в послеоперационном периоде. После радикального (оперативного) лечения их обследуют через 6—12 мес, а больных, не лечившихся радикально, — 3—4 раза в год.
Поскольку лечение ахалазии пищевода направлено на устранение основных симптомов заболевания, его нельзя считать патогенетическим; больные должны соблюдать основные условия труда и отдыха и периодически проходить обследование, даже при отсутствии клинической картины рецидива заболевания.
4.8.4. Гастроэзофагеальный рефлюкс
Термин «гастроэзофагеальный рефлюкс» (ГЭР) был введён для обозначения патологических синдромов, характеризующихся несостоятельностью антирефлюксного барьера.
Этиология и патогенез
Пищеводно-желудочный переход — основная анатомическая структура, препятствующая забросу желудочного содержимого в пищевод.
Антирефлюксный механизм
Для предотвращения заброса кислого желудочного содержимого в пищевод необходим функционирующий антирефлюксный механизм. На него влияют шесть факторов и физиологических механизмов:
1) сжимающее действие диафрагмы;
2) длина брюшного отдела пищевода;
3) угол Гиса;
4) клапан Губарева;
5) зона высокого давления;
6) внутрибрюшное давление.
Пищевод проходит через диафрагму в кольце, образованном волокнами правой ножки диафрагмы. Анатомические особенности этой области не препятствуют смещению пищевода вправо и вниз с сужением его просвета в момент вдоха. Нижний отдел пищевода соединяется с диафрагмой с помощью диафрагмально-пищеводной фасции (мембраны) Лаймера. Эта мембрана служит наружной границей перехода внутригрудного отдела пищевода в брюшной. За счёт сокращения правой ножки диафрагмы и мембраны Лаймера происходит увеличение давления в области нижнего пищеводного сфинктера (НПС).
Достаточная длина брюшного отдела пищевода необходима для нормального функционирования антирефлюксного барьера. Если при рентгенологическом исследовании этот отдел пищевода отсутствует, то существует угроза возникновения ГЭР. Важный фактор — протяжённость этого отдела. Чем длиннее брюшной отдел пищевода, тем выше эффективность замыкательного аппарата. В норме длина этого сегмента превышает 2 см. Этот показатель необходимо учитывать при выборе хирургического метода лечения.
Угол Ifoca образован дном желудка и стенкой пищевода. У детей с нормальной длиной брюшного отдела пищевода этот угол острый, что повышает эффективность запирательного барьера в 2 раза. Если угол Гиса тупой (грыжа пищеводного отверстия диафрагмы или после операции по поводу атрезии пищевода), желудочное содержимое беспрепятственно попадает в пищевод.
При нормальном угле Гиса существуют извилистые складки слизистой оболочки в форме розетки в области пищеводно-желудоч-ного перехода, образующие анатомический клапан Губарева. При повышении внутрижелудочного давления эти складки прижимаются друг к другу, образуя мягкий антирефлюксный клапан.
Зона высокого давления в области желудочно-пищеводного перехода — самостоятельный фактор антирефлюксного механизма. Её длина составляет 1 см у новорождённых и 2-4 см — у взрослых.
Для поддержания состоятельности НПС, выражающейся смыканием внутрибрюшного отдела пищевода, внутрибрюшное давление должно составлять 6—8 см вод.ст. Его снижение (при омфалоцеле, га-строшизисе или мышечной дистонии по гипотоническому типу) приводит к ГЭР.
Грыжа пищеводного отверстия диафрагмы или врождённый короткий пищевод, приводящие к несостоятельности брюшного сегмента пищевода, тупой угол Гиса, слабый клапан Губарева и уменьшение длины НПС приводят к развитию ГЭР.
При атрезии пищевода ГЭР развивается у 18—35% детей. При этой патологии выявляют нарушения перистальтики нижних отделов пищевода, приводящие к дисфагии. ГЭР при этом может приводить к стриктурам в области анастомоза.
Различают рефлюкс кислый, щелочной и смешанный.
• Соляная кислота и пепсин — основные факторы, вызывающие эзо-фагит. Повреждающее воздействие соляная кислота оказывает не напрямую, а вследствие активации пепсина. Активность пепсина максимальна при рН= 1,0-2,0. Повреждение пищевода кислым содержимым способствует стенозированию пищевода.
• Щелочной рефлюкс связан с забросом содержимого двенадцатиперстной кишки в желудок, а затем в пищевод. В этом случае на слизистую оболочку пищевода оказывает повреждающее воздействие и дуоденальное содержимое — секреты поджелудочной железы и жёлчь, при этом трипсин потенцирует повреждающее действие жёлчных кислот.
Дата добавления: 2015-09-07; просмотров: 741;
