Лечение 3 страница
Бронхоскопию обычно выполняют гибким фиброскопом с вмонтированными в него световодами, оптической системой и каналом Для инструментов, используемых при биопсии. Эта методика — малотравматичное вмешательство, дающее возможность даже у детей провести исследование на уровне сегментарных бронхов. С помощью этого исследования определяют функциональную способность трахеи и бронхов, проходимость, изменения слизистой оболочки,
характер отделяемого секрета, его количество. Обычно по распространённости выделяют бронхит локализованный (если он в одной доле) (рис. 4-8) или диффузный. Уже на основании бронхоскопической
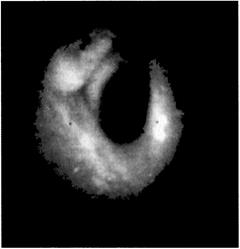
Рис. 4-8. Фибробронхоскопия. Локализованный гнойный эндобронхит при бронхоэктазах.
картины судят о необходимости дальнейшего специального обследования ребёнка и даже выявляют показания к проведению бронхографии. В части случаев бронхоскопию проводят не только с диагностической, но и лечебной целью — для аспирации мокроты и санации трахеобронхиального дерева, обнаружения и удаления инородного тела, резекции небольшой опухоли и др.
Фиброэзофагогастродуоденоскопия
Фиброэндоскопия у детей, выполняемая детскими моделями фиброскопов, даёт возможность осмотреть пищевод, желудок, двенадцатиперстную кишку у детей любого возраста, включая новорождённых. С помощью подобного исследования устанавливают уровень и степень выраженности поражений пищевода (эзофагита, стеноза и пр.). Удаётся осмотреть и кардиальный переход, при этом в супер-кардиальной области чётко видна зубчатая (Z-образная) линия, отделяющая бледно-розовую слизистую оболочку пищевода от красной
оболочки желудка. При необходимости для установления состояния слизистой оболочки или наличия возможного опухолевого процесса может быть выполнена щипцовая биопсия.
|манометрия пищевода
Манометрию пищевода детям проводят редко, в основном при недостаточности кардии (халазии) или с целью уточнения давления в кардии при ахалазии. Если градиент давления в желудке и пищеводе составляет от 5 до 15 см вод.ст., это можно считать нормой.
|рН-Метрия
рН-Метрию пищевода и желудка проводят при подозрении на же-лудочно-пищеводный рефлюкс. Используют миниатюрный зонд с датчиками, регистрирующими степень закисления в различных отделах пищевода. Нормой следует считать рН не менее 4,0.
4.2. Пороки развития грудной клетки
Врождённые пороки развития грудной клетки встречают примерно у 1 из 1000 детей. Наиболее часто, в 90% случаев по отношению ко всем видам пороков, выявляют воронкообразную деформацию грудной клетки. Среди более редких форм следует выделить килевидную деформацию, разнообразные аномалии развития рёбер, расщепление грудины и сочетанные варианты.
Причины образования перечисленных пороков окончательно не выяснены. Несомненно, что они возникают вследствие врождённой Дисплазии или аплазии хрящевой, реже костной части грудной клетки.
Большое значение имеет наследственный фактор. По данным многих авторов, до 20% детей с деформацией грудной клетки имеют родственников с аналогичной патологией. К настоящему времени описано большое количество синдромов, наряду с другими нарушениями включающих аномалии грудино-рёберного комплекса. Например, при синдроме Марфана (рис. 4-9) на фоне дизэмбриогенеза соединитель-Ной ткани отмечают астеническое телосложение, арахнодактилию, Подвывих и вывих хрусталиков, расслаивающую аневризму аорты, воронкообразную или килевидную деформацию грудной клетки, биохимические изменения обмена коллагена и гликозаминогликанов.
Знание признаков синдромов и их идентификация важны с точки зрения определения тактики и перспектив лечения. Так, при синдроме Элерса-Данлоса (четвёртая экхимозная форма) кроме костно-хрящевой патологии выявляют нарушения строения стенки сосудов. Во время хирургического лечения возможны осложнения, связанные с повышенной кровоточивостью. При выявлении у ребёнка различного рода костно-хрящевых деформаций целесообразна консультация генетика. При медико-генетическом консультировании по поводу спорадических случаев появления синдрома прогноз на рождение здорового ребёнка благоприятный.
4.2.1. Воронкообразная деформация грудной клетки
Внешние признаки воронкообразной деформации грудной клетки характеризуются западением грудины и прилежащих частей рёбер. Рёберные дуги несколько развёрнуты, эпигастральная область выбухает (рис. 4-10).
Клиническая картина и диагностика
Как правило, деформацию выявляют сразу после рождения. Характерно западение рёбер и грудины при вдохе. Примерно у половины больных по мере роста деформация прогрессирует до 3-5 лет. Деформация может появиться в более поздние сроки — обычно в период ускоренного роста ребёнка. Замечено, что наиболее тяжёлые формы деформации проявляются рано. Деформации, возникшие в пубертатный период, редко бывают выраженными.
При осмотре ребёнка можно выявить стигмы, характерные для того или иного наследуемого синдрома (повышенную подвижность суставов, плоскую спину, сниженный тургор тканей, плохое зрение, готическое нёбо и т.д.).
Наряду с данными осмотра имеют значение рентгенологические и функциональные методы исследования. На рентгенограмме в прямой проекции выявляют смещение сердца (обычно влево), что косвенно позволяет судить о влиянии деформации на функции сердца. По боковой рентгенограмме определяют глубину вдавления грудины, измеряют грудо-позвоночный индекс, или индекс Гижицкой.
Последний представляет собой отношение наименьшего расстояния между задней стенкой грудины и передним краем позвоночника к наибольшему. На этом строят классификацию воронкообразной деформации грудной клетки:
• по степени: I степень — 1—0,7; II степень — 0,7-0,5; III степень — менее 0,5;
• по форме — симметричная, асимметричная и плоская. Функциональные изменения внешнего дыхания и гемодинамики
обнаруживают при выраженной деформации, и они прямо зависят от её степени. Нарушения внешнего дыхания проявляются снижением максимальной вентиляции лёгких, увеличением минутного объёма дыхания и показателя потребления кислорода в минуту. Коэффициент использования кислорода снижен. Характерны изменения на ЭКГ. Однако наиболее информативным исследованием сердца считают эхокардиографию, позволяющую уточнить морфологические изменения сердца. Это важно в связи с тем, что при воронкообразной деформации грудной клетки, особенно при наследуемых синдромах, часто встречают пролапс митрального клапана.
Лечение
Консервативных методов лечения воронкообразной деформации грудной клетки нет. Показания к операции определяют на основании степени и формы заболевания. Торакопластика абсолютно показана при воронкообразной деформации грудной клетки III степени и показана при патологии II степени. При I степени (за исключением плоских форм) торакопластику обычно не проводят. Оптимальный возраст для выполнения операции — 5 лет. С большой осторожностью следует подходить к хирургическому лечению детей с деформациями на фоне наследуемых синдромов. Только после всестороннего обследования и при отсутствии противопоказаний можно рекомендовать операцию.
Операция заключается в субперихондральном иссечении искривлённых рёберных хрящей, поперечной клиновидной стернотомии и фиксации грудины в исправленном положении металлической пластиной.
В последнее время широкое распространение получил метод Нас-са, при котором резекцию хрящей и пересечение грудины не выполняют. Результаты этой операций наиболее выгодны (рис. 4-11).
Результаты хирургической коррекции воронкообразной деформации хорошие (по данным разных авторов, в 80-97% случаев). Рецидивы возникают при недостаточной фиксации грудины, чаще у детей с наследуемыми формами, оперированными в ранние сроки.
4.2.2. Килевидная деформация грудной клетки
к Килевидная деформация грудной клетки, также как и воронкообразная, — порок развития. Килевидная деформация может быть составным компонентом одного из наследуемых синдромов.
| Клиническая картина и диагностика |
Обычно деформацию выявляют с момента рождения с возрастом степень деформации увеличивается. Выступающая вперёд грудина и западающие по её краям рёбра придают грудной клетке характерную килевидную форму (рис. 4-12). Деформация может быть симметричной и асимметричной. При асимметричной форме хрящевые отделы рёбер приподнимают грудину с одной стороны, и она

искривляется по оси. Встречают комбинированные формы, когда верхняя треть грудины приподнята, а нижняя часть с мечевидным отростком резко западает.
Функциональные расстройства обычно не развиваются. При синдромальных формах и выраженном уменьшении объёма грудной клетки возможны жалобы на быструю утомляемость, одышку, сердцебиение при физической нагрузке. Однако в большинстве случаев детей и их родителей беспокоит косметический дефект.
Лечение
Показания к операции возникают в основном у детей старше 5 лет при выраженном косметическом дефекте. Предложено несколько способов оперативных вмешательств. В их основе лежат субпе-рихондральная резекция парастерналь-ной части рёбер, поперечная стерното-мия и отсечение мечевидного отростка. Фиксацию грудины в правильном положении осуществляют за счёт сшивания грудины с надхрящницей и оставшимися концами рёбер. Результаты хирургического лечения килевидной деформации хорошие (рис. 4-13).
4.2.3. Аномалии рёбер
Аномалии рёбер могут заключаться в деформации или отсутствии отдельных рёберных хрящей, раздвоении и синостозах рёбер, деформации групп рёберных хрящей, отсутствии или широком расхождении рёбер.
Раздвоение грудных отделов рёбер
Раздвоение грудных отделов рёбер (ребро Люшке) обычно проявляется в виде плотного выступающего образования, расположенного рядом с грудиной. В редких случаях приходится проводить дифференциальную диагностику с опухолевым процессом. Лечение необходимо только при значительных деформациях с косметической целью. Оно состоит в субхондральном удалении деформированных хрящей.
Церебро-косто-мандибулярный синдром
Дефекты рёбер (отсутствие, раздвоение, псевдоартрозы и др.) сочетаются с незаращением верхнего нёба или готическим нёбом, гипоплазией нижней челюсти, микрогнатией, глоссоптозом, микроцефалией. Хирургическое лечение показано в крайних случаях при значительном дефекте грудной стенки, сопровождающемся парадоксальным дыханием.
Синдром Поланда

Синдром Поланда всегда характеризуется односторонним поражением, включающим аплазию или гипоплазию большой грудной мышцы и гипоплазию малой грудной мышцы (рис. 4-14). Синдром
нередко сопровождается отсутствием части подлежащих рёберных хрящей и рёбер, аплазией или гипоплазией соска, аплазией молочной железы у девочек, деформацией руки и кисти. Диагностика основана на внешнем осмотре. Для уточнения состояния рёбер применяют рентгенографию. При наличии значительного дефекта с образованием лёгочной грыжи проводят пластику рёберного дефекта с использованием аутотрансплантации рёбер со здоровой стороны. Возможно использование выше- и нижележащих рёбер с их расщеплением и смещением в сторону дефекта. Некоторые хирурги успешно применяют синтетические материалы. Для замещения отсутствующих мышц выполняют перемещение лоскута или всей широчайшей мышцы спины. Операции при широких дефектах с парадоксальным дыханием выполняют в раннем возрасте.
Расщепление грудины
Расщепление грудины — редкий порок развития. Он заключается в наличии продольной щели, расположенной по срединной линии. Дефект может быть различным по протяжённости и ширине, вплоть до полного расщепления грудины. При этом возникает парадоксальное движение органов средостения, покрытых в месте дефекта только истончённым слоем мягких тканей и кожей. Видна пульсация сердца и крупных сосудов (рис. 4-15). Порок выявляют в первые месяцы жизни; по мере роста ребёнка выраженность порока увеличивается. Наряду с анатомическими проявлениями выявляют и функциональные расстройства. Возможны нарушения дыхания вплоть до приступов цианоза. Дети обычно отстают в физическом развитии.
Операцию выполняют в раннем возрасте. Она заключается в освобождении краёв дефекта, сшиваемых затем на всём протяжении узловыми швами.
4.3. Пороки развития молочных желёз
Полное отсутствие молочной железы с одной или обеих сторон встречают редко. Чаще выявляют их недоразвитие.
Одностороннее отсутствие или гипоплазия молочной железы бывает при синдроме Поланда. Косметические операции выполняют девочкам старшего возраста.
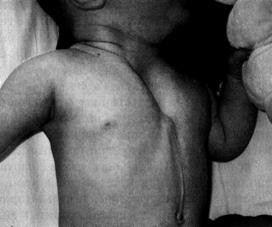
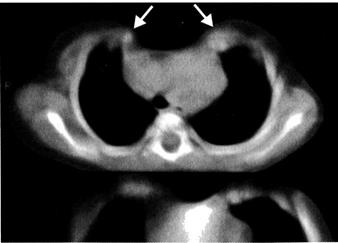
Рис. 4-15. Расщепление грудины: а — общий вид; б — КТ, диастаз между краями грудины (указан стрелками).
Множественные молочные железы и множественные соски встречают также редко. Их количество и размер могут быть различными. Лечение заключается в удалении добавочных желёз и сосков из косметических соображений.
Пубертатная макромастия — увеличение молочных желёз у девочек в возрасте 10-15 лет, превышающее физиологические нормы.
Во время полового созревания ткань молочной железы избыточно про-лиферирует, в результате чего образуется одна или две гигантские железы. Обратного развития подобной гипертрофии не бывает. Хирургическое лечение заключается в частичном удалении молочных желёз.
Гинекомастия — увеличение одной или двух грудных желёз у мальчиков в период полового созревания. Различают истинную гинекомастию и псевдогинекомастию. Истинная гинекомастия связана с увеличением количества железистой ткани, содержащейся в железе. Псевдогинекомастия — результат отложения жира в области молочных желёз. Истинную гинекомастию встречают приблизительно у половины мальчиков в возрасте 14—15 лет. Она связана с нарушением соотношения содержания андрогенов и эстрогенов в процессе полового развития. Железа в этот период увеличена, пальпаторно уплотнена, умеренно болезненна. Пациента следует направить к эндокринологу. Истинная гинекомастия обычно проходит самостоятельно. В выраженных случаях возможно назначение лекарственных средств, регулирующих секрецию пролактина. При неэффективности консервативной терапии выполняют операцию — вылущивание железы.
Необходимо помнить, что увеличение молочной железы в любом возрасте у детей любого пола может быть связано с опухолевым процессом. Фиброаденомы, кисты молочной железы и другие доброкачественные образования необходимо дифференцировать от злокачественных опухолей, встречающихся очень редко. Тем не менее при одностороннем плотном образовании неправильной формы показана биопсия.
4.4. Врождённые и приобретённые стенозы трахеи и бронхов
Врождённые и приобретённые стенозы трахеи и бронхов встречают очень редко. В зависимости от причины возникновения выделяют стенозы собственно трахеи и бронхов и сужения, вызванные сдав-лением дыхательных путей (компрессионные стенозы).
Клинические проявления порока возникают при уменьшении диаметра трахеи на 50% и более. Во всех случаях нарушение трахео-бронхиальной проходимости клинически проявляется стридорозным дыханием, эмфиземой или гиповентиляцией лёгких и развитием тра-хеобронхита ниже места обструкции. Причины наиболее часто встречающихся стенозов представлены в табл. 4-1.

4.4.1. Врождённые стенозы трахеи и бронхов
Сосудистое кольцо
Наиболее часто встречают стенозы, обусловленные сдавлением трахеи порочно развитой аортой (двойная дуга), образующей сосудистое кольцо, охватывающее трахею и пищевод (рис. 4-16).
Это единственная форма сужения трахеи, при которой кроме сужения трахеи всегда бывает сдавление пищевода. Данный признак помогает дифференцировать этот стеноз от других сужений уже при рентгенологическом исследовании пищевода с контрастным веществом в боковой проекции (рис. 4-17). При этом на задней стенке пищевода определяют вдавление одного из стволов дуги аорты.
При бронхоскопии выявляют вдавление передней стенки средней трети трахеи. Диагноз может быть подтверждён при УЗИ дуги аорты. В сомнительных случаях необходимо проведение аортографии.
Лечение стеноза заключается в пересечении сосудистого кольца. Этот порок всегда сопровождается признаками трахеомаляции (расширения трахеи и размягчения хряща вследствие морфологической неполноценности) в месте наибольшего сдавления трахеи аортой. Поэтому операцию всегда следует дополнять фиксацией переднего ствола аорты к грудине (аортопексией). Это уменьшает проявления трахеомаляции в послеоперационном периоде.

Рис. 4-16. Сосудистые кольца, вызывающие сужения трахеи: а — норма; б — двойная дуга аорты; в — петля лёгочной артерии. Ао — аорта, Лс — лёгочный ствол.
|Петля лёгочной артерии
Петля лёгочной артерии вызывает стеноз в области бифуркации трахеи (см. рис. 4-16). Нередко этот порок сочетается с наличием полных хрящевых колец трахеи.
| Бронхогенная киста |
Бронхогенная киста располагается между трахеей и пищеводом (рис. 4-18). Сдавление трахеи происходит сзади. При трахеоско-пии можно выявить пролабирование мембранозной части трахеи

на ограниченном участке (рис. 4-19). Лечение порока состоит в удалении кисты.
Врождённые стенозы собственно трахеи
Врождённые стенозы собственно трахеи связаны с наличием полных хрящевых колец и отсутствием мембранозной части трахеи на определённом участке. Патологию можно определить при трахеоскопии. При наличии стеноза, захватывающего менее 30% длины трахеи, возможно выполнение резекции суженного участка с наложением межтрахеального анастомоза по типу «конец-в-конец». Лечение стенозов большей протяжённости окончательно не разработано.
4.4.2. Приобретённые стенозы трахеи и бронхов
Наиболее частые причины приобретённых стенозов трахеи и бронхов — тра-хеостомия и длительное нахождение в дыхательных путях инородных тел, особенно растительного происхождения.
Лечение
Лечение приобретённых стенозов собственно трахеи целесообразно начинать с эндоскопических манипуляций, направленных на удаление рубца через бронхоскоп. При отсутствии эффекта показана резекция трахеи с наложением межтрахеального анастомоза.
При наличии стеноза бронхов перед лечением необходимо выполнение бронхоскопии на стороне поражения.
При формировании бронхоэктазов ниже места обструкции ликвидацию стеноза следует сочетать с удалением поражённой части лёгкого.

Наилучший способ лечения стеноза после разрыва бронхов — резекция суженного участка с формированием трехеобронхиального анастомоза.
4.5. Пороки развития лёгких
Нарушения процесса эмбриогенеза лёгких обусловливают появление различных пороков развития лёгких. Прекращение роста брон-холёгочных почек на ранних стадиях (4-я неделя) приводит к агене-зии одного или обоих лёгких; задержка развития бронхолёгочных почек на 5-й неделе обусловливает возникновение аплазии или глубокой гипоплазии лёгких, на 5—6-й неделе — возникновение агене-зии, аплазии или гипоплазии долей.
К наиболее частым порокам, связанным с развитием анатомических, структурных и тканевых элементов лёгкого, следует отнести агенезию и аплазию лёгких, гипоплазию, врождённую долевую эмфизему; к порокам развития, связанным с наличием избыточных дизэмбриогенетических формирований, — добавочное лёгкое с
аномальным кровоснабжением (внедолевая секвестрация), кисту лёгкого, гамартому. Среди пороков развития сосудов лёгких, имеющих клиническое значение и относящихся в большей степени к пульмонологии, следует назвать артериовенозные свищи.
4.5.1. Агенезия и аплазия лёгкого
Под агенезией следует понимать отсутствие лёгкого одновременно с отсутствием главного бронха.
Аплазия — отсутствие лёгкого или его части при наличии сформированного либо рудиментарного бронха. При двусторонней аге-незии или аплазии лёгких дети нежизнеспособны, а при одностороннем пороке могут жить и нормально развиваться.
Клиническая картина
Клиническая картина этих пороков весьма сходна и проявляется такими симптомами, как дыхательная асимметрия, притупление перкуторного звука, а также выявляемое при аускультации отсутствие или значительное ослабление дыхания на стороне поражения, клинические и рентгенологические симптомы смещения средостения в больную сторону. На обзорной рентгенограмме органов грудной клетки возможно выявление тотального затенения половины грудной полости (рис. 4-20). Со временем может присоединяться симптом медиа-стинальной грыжи, обусловленный перемещением части лёгкого на противоположную сторону. Такая клинико-рентгенологическая картина напоминает ателектаз новорождённых, в дифференциальной диагностике с которым могут быть использованы такие дополнительные методы исследования, как бронхоскопия, бронхография (рис. 4-21), ангиопульмонография. Обычно при таких пороках хирургическое лечение не показано.
4.5.2. Гипоплазия лёгкого
Гипоплазия лёгкого — недоразвитие всех его структурных элементов. Недоразвитие может касаться обоих лёгких, целиком одного лёгкого или его части (доли, сегмента). В связи с этим становится понятно, что термин «гипоплазия» объединяет ряд пороков, форма которых зависит от стадии эмбриогенеза, на которой
прекратилась или задержалась дифференцировка структурных элементов лёгкого.
Формы гипоплазии лёгкого
Большинство клиницистов описывают две наиболее распространённые формы гипоплазии лёгких — простую и кистозную.
Простая форма гипоплазии
Простая форма гипоплазии характеризуется равномерным уменьшением объёма лёгкого или доли, сужением бронхов и сосудов.
Клиническая форма этого порока зависит, как и при многих других формах, от объёма поражения и наличия (отсутствия) воспалительных изменений в порочном или смежных с ним отделах лёгкого. При этом могут быть признаки дыхательной недостаточности, асимметрия грудной клетки и дыхательная асимметрия, клинические и рентгенологические симптомы смещения органов средостения в сторону уменьшенного лёгкого. В разной степени нарушенные функции вентиляции, секреции, дренажной функции бронхов могут сопровождаться соответствующими клинико-рентгенологическими симптомами: притуплением перкуторного звука с ослаблением дыхания, наличием сухих и влажных разнокалиберных хрипов, изменением прозрачности лёгочной ткани.
Однако основной фактор, обусловливающий клиническую картину, — гнойно-воспалительный процесс в гипоплазированной части лёгкого, часто сопровождающий пороки развития лёгких. Именно повторные воспалительные заболевания лёгких соответствующей локализации чаще всего становятся поводом заподозрить наличие порока. Проведение в этих случаях дополнительных и специальных исследований (таких, как бронхоскопия, бронхография, ангиопуль-монография, радиоизотопное сканирование лёгких), как правило, позволяет уточнить диагноз.
Во время бронхоскопии определяют выраженность и локализацию воспалительных изменений, варианты отхождения бронхов, степень сужения их устьев и т.д. На бронхограмме, как правило, выявляют деформацию бронхиального дерева. Ангиопульмонография показывает значительное обеднение кровотока. Радиологические методы позволяют определить степень функциональных нарушений (вентиляции и кровотока) в зонах, соответствующих локализации порока.
Кистозная гипоплазия лёгкого
Кистозная гипоплазия лёгкого (врождённый поликистоз) — порок развития, при котором терминальные отделы бронхиального дерева на уровне субсегментарных бронхов или бронхиол представляют собой расширения кистообразной формы различных размеров.
Клиническая картина кистозной формы гипоплазии мало отличается от простой, однако на рентгенограмме в зоне, соответствующей пороку, могут определяться множественные тонкостенные воздушные полости, обычно не содержащие жидкости. Длительное существование таких полостей, накопление в них бронхиального секрета, его застой и инфицирование приводят, как правило, к гнойно-воспалительному процессу. Наиболее характерны интоксикация, влажный кашель с гнойной мокротой, дыхательная недостаточность, а также симптомы, обусловленные изменением объёма лёгочной ткани в связи с её недоразвитием и воспалением в ней.
Рентгенологически в этот период в кистозных полостях могут появляться множественные уровни жидкости. При длительном существовании воспалительного процесса нередко возникают трудности в дифференциальной диагностике кистозной гипоплазии и бронхо-эктазии (рис. 4-22).
Лечение
Лечение гипоплазии оперативное, заключающееся в удалении поражённой части лёгкого. Следует обращать внимание на максимальное купирование острого воспалительного процесса перед операцией, что позволяет снизить процент послеоперационных осложнений и улучшить результаты оперативного лечения.
Морфологическое подтверждение диагноза гипоплазии лёгкого — основание для постоянного диспансерного наблюдения за такими больными в послеоперационном периоде, так как у них нельзя исключить наличия менее выраженных нарушений в структурных элементах оставшихся отделов лёгких, что в свою очередь может привести к развитию воспалительных изменений в них.
4.5.3. Врождённая локализованная эмфизема
Этот порок развития характеризуется растяжением (эмфиземой) части лёгкого (чаще одной доли). Для его обозначения употребляют также термины «врождённая долевая эмфизема», «локализованная эмфизема», «обструктивная эмфизема», «гипертрофическая эмфизема». Истинные причины порока остаются невыясненными. Однако некоторые авторы связывают его возникновение с аплазией хрящевых элементов бронхов, гипоплазией эластических волокон и гладких мышц терминальных и респираторных бронхиол и другими нарушениями в структурных единицах лёгочной ткани. Эти факторы создают предпосылки для возникновения клапанного механизма, способствующего чрезмерному вздутию соответствующей части лёгкого и развитию дыхательных нарушений.
Клиническая картина и диагностика
Клинические нарушения обусловлены наличием и выраженностью симптомов дыхательной и сердечно-сосудистой недостаточности. В патогенезе дыхательной недостаточности играют роль следующие факторы: выключение из дыхательной функции большого объёма лёгочной ткани (отсутствие дыхательной функции в порочно развитом отделе лёгкого и коллабирование нормально сформированных отделов в результате сдавления их чрезмерно растянутыми отделами порочного лёгкого), а также шунтирование крови в коллабированной части лёгкого.
Повышение внутригрудного давления и смещение средостения, нередко встречающиеся при этом пороке развития, становятся другим патогенетическим механизмом, обусловливающим сердечно-сосудистые нарушения у таких больных.
Различают декомпенсированную, субкомпенсированную и компенсированную формы врождённой долевой эмфиземы. При деком-пенсированной форме порок проявляет себя с рождения. Довольно часто при этом могут быть выражены общий цианоз, одышка, дыхательная асимметрия (отставание в акте дыхания вздутой половины грудной клетки), беспокойство ребёнка, частый сухой кашель, приступы асфиксии при кормлении.
Решающим в диагностике становится рентгенологическое исследование, при котором можно выявить повышение прозрачности лёгочной ткани вплоть до полного исчезновения лёгочного рисунка, смещение средостения, иногда с наличием «медиастинальной грыжи», поджатие здоровых отделов лёгкого в виде треугольной тени ателектаза. Последний признак чрезвычайно важен в дифференциальной диагностике с пневмотораксом (рис. 4-23). Наиболее

При компенсированной форме врождённой долевой эмфиземы перечисленные симптомы могут быть выражены крайне слабо, непостоянны, заметны лишь опытному клиницисту. Нередко только возникновение воспалительных изменений в порочном отделе лёгкого или коллабирование в других отделах становится поводом для рентгенологического обследования, позволяющего поставить точный диагноз.
Дата добавления: 2015-09-07; просмотров: 1473;
