Методы определения порядка реакции
Определение порядка реакции открывает возможности выяснения вероятного механизма химического процесса. Для определения порядка реакции надо знать кинетические уравнения реакций различного порядка. В общем виде кинетическое уравнение реакции, например, первого порядка выглядит следующим образом: 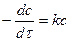 ,
,
где с – концентрация исходного вещества, поэтому перед производной знак «–». После интегрирования этого уравнения, обозначив начальную концентрацию вещества через с0, получим:
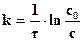 (2.2)
(2.2)
Кинетическое уравнение реакции второго порядка, считая концентрации реагентов одинаковыми с1=с2=с, выглядит:
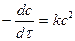 .
.
Интегрируя это уравнение и обозначив через с0 начальную концентрацию, получим:
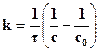 (2.3.)
(2.3.)
Экспериментально находят концентрации одного из веществ (с) через разные промежутки времени (t) от начала реакции. Значения (с) и начальной концентрации (с0) подставляют в уравнение (2.2) и рассчитывают константу скорости. Если величина (k), вычисленная для разных моментов времени, остается практически постоянной, это говорит о том, что реакция первого порядка. Если значения (k) не сохраняют постоянного значения, то величины (с) и (с0) подставляют в уравнение (2.3.) Постоянство значений (k) свидетельствует о втором порядке реакции.
Можно эти расчеты проделать графически. Из уравнения (2.2) следует, что график зависимости (lnc) от времени (t) должен иметь вид прямой линии. Действительно уравнение (2.2) можно записать как:
- 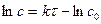 .
.
Так как (-lnс0) величина постоянная, то, обозначив ее через (В), получим:
-ln c=kt+B,
а это и есть уравнение прямой в координатах lnc-t. Полученные экспериментальные значения (с) наносят на график в этих координатах (рис. 2.1). Если получается прямая линия, то реакция имеет первый порядок. Тангенс угла наклона этой прямой (tga) равен k, а отрезок, отсекаемый ею на оси ординат равен ln с0.
Из уравнения (2.3) следует, что зависимость 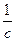 от t выражается прямой линией, так как это уравнение можно представить в виде:
от t выражается прямой линией, так как это уравнение можно представить в виде:
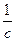 =kt + В, где В=
=kt + В, где В= 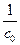 .
.
Если экспериментальные точки в координатах lnc-t не ложатся на прямую линию, то строят график в координатах 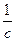 –t (рис. 2.2). Если получается прямая линия, то реакция второго порядка, а тангенс угла наклона прямой по отношению к оси абсциссе (tg a) равен (k). Отрезок, отсекаемый прямой не оси ординат, равен
–t (рис. 2.2). Если получается прямая линия, то реакция второго порядка, а тангенс угла наклона прямой по отношению к оси абсциссе (tg a) равен (k). Отрезок, отсекаемый прямой не оси ординат, равен 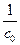 .
.
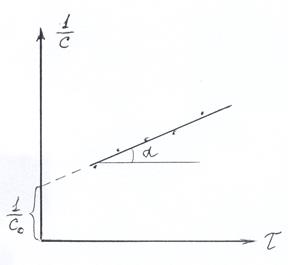
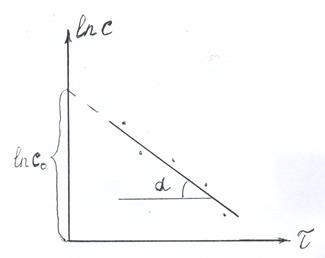
Рис. 2.1 Рис. 2.2
Порядок реакции можно определять по периоду полупревращения. Периодом полупревращения называется время, в течение которого в реакцию вступит половина исходного количества вещества.
Подставив в уравнение (2.2) величину 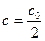 , получим:
, получим:
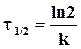 . (2.4).
. (2.4).
Т.е. период полупревращения реакции первого порядка связан только с величиной константы скорости (k) и не зависит от начальной концентрации вещества.
Для реакции второго порядка, подставив в уравнение (2.3) величину 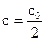 , получим:
, получим:
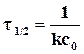 (2.5).
(2.5).
Таким образом, для реакции второго порядка период полупревращения уменьшается с увеличением начальной концентрации реагентов.
Для определения порядка реакции проводят реакцию при различных начальных концентрациях вещества (с0) и определяют период полупревращения. Если реакция имеет первый порядок, то период полупревращения при разных (с0) будет одним и тем же. Если период полупревращения обратно пропорционален начальной концентрации, реакция имеет второй порядок. Зная порядок реакции, можно рассчитать константу скорости по уравнениям (2.4) или (2.5).
Дата добавления: 2015-09-28; просмотров: 1751;
