При повышении температуры на каждые 100 скорость химической реакции увеличивается в 2-4 раза.
Для объяснения влияния температуры из кинетической теории газов была выведена теория активных столкновений. Аррениус высказал предположение, что столкновение молекул (или других частиц) может приводить к реакции только в том случае, если энергия сталкивающихся молекул равна или больше некоторой минимальной энергии.Минимальная энергия, которая необходима для химического взаимодействия, получила название энергии активации ЕА. Математическое соотношение между скоростью реакции, частотой столкновений и вероятностью того, что энергия молекул превосходит величину ЕА получило название уравнения Аррениуса.
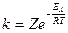 ,
,
где k – константа скорости реакции; R – газовая постоянная; Т – абсолютная температура; Z – число столкновений.
Множитель 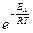 , называемый экспоненциальным, характеризует долю активных столкновений, а значит и константа скорости тем больше, чем меньше энергия активации и чем выше температура. Таким образом, увеличение скорости реакции при повышении температуры связано с увеличением доли активных молекул.
, называемый экспоненциальным, характеризует долю активных столкновений, а значит и константа скорости тем больше, чем меньше энергия активации и чем выше температура. Таким образом, увеличение скорости реакции при повышении температуры связано с увеличением доли активных молекул.
Уравнение Аррениуса можно также представить в следующем виде:
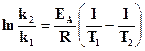 , (2.6)
, (2.6)
где k1 и k2 – константы скорости соответственно при температурах Т1 и Т2.
С помощью этого уравнения можно производить следующие расчеты:
а) если известны ЕА и k1, можно рассчитать k2;
б) можно рассчитать энергию активации (ЕА), если известны константы скорости при двух температурах.
Дата добавления: 2015-09-28; просмотров: 1483;
