Скорость химической реакции. Скорость химической реакции – это изменение концентрации реагирующих веществ за единицу времени
Скорость химической реакции – это изменение концентрации реагирующих веществ за единицу времени. Если за какое-то время Dt концентрация реагирующего вещества изменилась на величину Dс, то средняя скорость реакции:
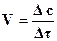 (2.1.)
(2.1.)
В ходе реакции ее скорость не остается постоянной, она максимальна в начальный момент и далее постепенно уменьшается. Если взять бесконечно малый отрезок времени dt, получаем выражение для мгновенной скорости в любой конкретной момент времени:
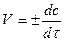 .
.
Если о скорости реакции судить по изменению концентрации продуктов реакции, то производная 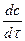 имеет знак «+», так как их концентрация с течением времени увеличивается. Если же судить по изменению концентрации исходных веществ, которая уменьшается с течением времени, то производная отрицательна. Но скорость не может быть отрицательной, поэтому в этом случае перед производной стоит знак «-». Размерность скорости реакции: [размерность концентрации · время -1 ].
имеет знак «+», так как их концентрация с течением времени увеличивается. Если же судить по изменению концентрации исходных веществ, которая уменьшается с течением времени, то производная отрицательна. Но скорость не может быть отрицательной, поэтому в этом случае перед производной стоит знак «-». Размерность скорости реакции: [размерность концентрации · время -1 ].
Экспериментально установлено, что на скорость химических реакций влияют следующие факторы:
1. Природа реагирующих веществ. Например, скорость реакций, в которых взаимодействуют ионы, выше тех, в которых взаимодействуют ковалентно связанные молекулы. Или, если реагирующие молекулы достаточно сложны, то скорость реакции еще меньше, так как для того, чтобы между ними произошла реакция, они должны быть определенным образом ориентированы в пространстве.
2. Концентрация реагирующих веществ. Скорость химической реакции, при прочих равных условиях, зависит от числа столкновений реагирующих частиц в единицу времени. Вероятность столкновений зависит от количества частиц в единице объема, т.е. от концентрации. Поэтому скорость реакции увеличивается с повышением концентрации.
3. Физическое состояние веществ.В гомогенных системах скорость реакции зависит от числа столкновений частиц в объеме раствора или газа. В гетерогенных системах химическое взаимодействие происходит на поверхности раздела фаз. Увеличение площади поверхности твердого вещества при его измельчении облегчает доступ реагирующих частиц к частицам твердого вещества, что приводит к существенному ускорению реакции.
4. Температура оказывает существенное влияние на скорость химических реакций. При увеличении температуры повышается кинетическая энергия частиц, а, следовательно, увеличивается доля частиц, энергия которых достаточна для химического взаимодействия.
5. Наличие катализаторов.Катализаторами называются вещества, в присутствии которых изменяется скорость химических реакций. Вводимые в реакционную систему в небольших количествах и остающиеся после реакции неизменившимися, они способны чрезвычайно менять скорость процесса.
Дата добавления: 2015-09-28; просмотров: 931;
