Химическая связь. Полярные и неполярные молекулы
Прежде чем говорить о химической связи вспомним понятия об атоме и молекуле.
Атом – наименьшая электронейтральная частица химического элемента, сохраняющая его химические свойства. Атом состоит из положительно заряженного ядра, вокруг которого по определенным орбитам вращаются электроны. Ядро атома состоит из протонов и нейтронов. Свойства элементарных частиц, из которых состоит атом, приведены в таблице 1.1.
Из табл. 1.1. следует, что заряд протона по величине равен заряду электрона, но противоположен ему по знаку. Массы протона и нейтрона одинаковы и в 1840 раз превышают массу покоя электрона. Ядро занимает ничтожную часть пространства внутри атома; если атом имеет размер порядка 10-10м, то радиусы атомных ядер находится в пределах 10-15-10-14м,
Таблица 1.1.
Свойства элементарных частиц, образующих атомы
| Частица | Обозначение | Масса покоя, кг | Заряд, Кл |
| Электрон | е | 9.109·10-31 | -1,602·10-19 |
| Протон | р | 1,673·10-27 | 1,602·10-19 |
| Нейтрон | n | 1.675·10-27 |
т.е. атом в десятки тысяч раз больше ядра. В то же время почти вся масса атома сосредоточена в его ядре. Это указывает на то, что атом практически пустой. Вот почему физики теоретики всерьез рассуждают о том, что вселенную можно сжать в точку.
Так как заряд электрона является минимальной величиной заряда, то этот заряд принят за (-1). И оказалось, что число протонов в ядре, а, следовательно, и число электронов в атоме, равно порядковому номеру элемента в таблице Менделеева.
В современной модели атома состояние в нем электрона определяется четырьмя параметрами – квантовыми числами:главным (n), побочным или орбитальным (l), магнитным (m) и спиновым (s). Сочетание первых трех квантовых чисел (n, l, m) показывает, где в данный момент времени находится электрон в околоядерном пространстве, а спиновое (s) является собственной характеристикой электрона. Оно может принимать только два значения. Электроны, находящиеся на внешних орбитах (атомных орбиталях, энергетических уровнях) различных атомов, могут взаимодействовать при столкновении этих атомов. В результате этого электроны, называемые валентными, «обслуживают» ядра всех взаимодействующих атомов. Такое состояние энергетически выгодно. Между атомами возникает химическая связь, и они создают молекулу. Таким образом, химическая связь между атомами возникает за счет взаимодействия электронов внешних орбит атомов. Следовательно, молекула– наименьшая частица данного вещества, обладающая его химическими свойствами. Молекула состоит из атомов, между которыми существует химическая связь. Химические свойства молекулы определяются ее составом (атомами) и строением (химическими связями).
Валентные электроны при взаимодействии двух атомов могут распределяться в молекуле АВ симметрично (рис. 1.1,а), и такую химическую связь называют ковалентной неполярной. Центры тяжестей положительных и отрицательных зарядов в такой молекуле совпадают. Когда валентные электроны полностью переходят к одному из атомов возникает ионная связь (рис. 1.1,б). Если валентные электроны в молекуле распределены неравномерно за счет смещения к более электроотрицательному атому, то возникает ковалентная полярная связь. Центры тяжестей отрицательных и положительных зарядов в молекуле не совпадают, между ними возникает некоторое расстояние (l) (рис 1.1, в).
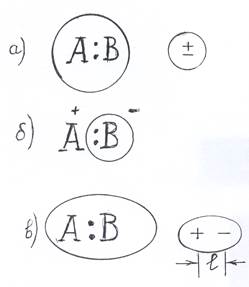
Рис. 1.1. Схемы различных типов химической связи
Полярность молекул характеризуется дипольным моментом m:
m = q · l, (1.1)
где q – абсолютное значение зарядов, пропорциональное заряду электрона.
Так как расстояние между атомами в молекулах есть величина порядка 10-10м, а заряд электрона равен 1,6·10-19Кл, то дипольные моменты молекул или отдельных химических связей имеют величину порядка 10-30Кл·м. Часто дипольные моменты приводят в единицах дебая (D): 1D=3,336·10-30Кл·м.
Если в молекуле несколько полярных связей, то дипольные моменты этих связей суммируют как векторы. Поэтому возможны случаи, когда отдельные связи в молекуле полярны, а суммарный дипольный момент равен нулю (т.е. молекула в целом неполярна). Например, в молекуле СО2 дипольные моменты (на рис. 1.2. изображены векторами) двух полярных связей С =О взаимно уничтожаются. Молекула же Н2О полярна, так как она нелинейна, т.е. связи О―Н расположены под углом, не равным 1800.
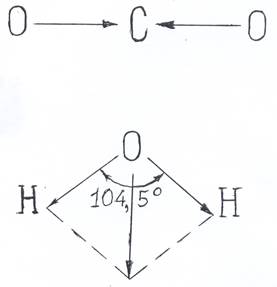
Рис. 1.2. Сложение дипольных моментов связей в молекуле
1.2. Поляризация. Молярная рефракция
Если какое-нибудь вещество поместить во внешнее электрическое поле, то атомы, молекулы или ионы этого вещества под действием этого поля претерпевают те или иные изменения, которые объединяются общим названием поляризация. Для полярных молекул различают ориентационную, атомную и электронную поляризацию (рис. 1.3.).
Ориентационная поляризация – ориентация полярных молекул в соответствии с направлением поля. При повышении температуры она уменьшается, т.к. усиливается тепловое движение молекул.
Атомная поляризация – смещение ядер атомов, из которых состоит молекула, под действием поля. При этом смещается центр тяжести положительных зарядов.
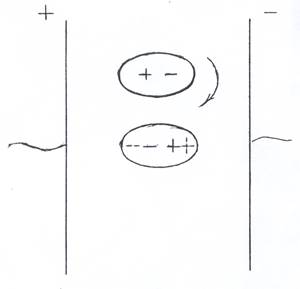
Рис. 1.3 Виды поляризации
Электронная поляризация – смещение электронов в молекуле относительно ядер атомов под действием поля. При этом смещается центр тяжести отрицательных зарядов.
При воздействии переменного электрического поля (меняется напряженность поля по величине и направлению с определенной частотой) частотой более 1013Гц, например, видимого света (частота порядка 1015Гц), остается только электронная поляризация, так как электроны обладают много меньшей массой, чем ядра и молекулы. Электронную поляризациюодного моля вещества называют молярной рефракцией (Rм), которая определяется следующим соотношением:
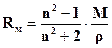 , (1.2.)
, (1.2.)
где n – показатель преломления света (отношение синуса угла падения к синусу угла преломления); М – молярная масса, 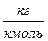 ; ρ – плотность вещества,
; ρ – плотность вещества, 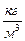 .
.
Если подставить размерность величин, входящих в эту формулу, то получим размерность молярной рефракции 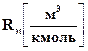 . По размерности и по физическому смыслу молярная рефракция представляет собой объем, занимаемый молекулами одного киломоля вещества. Она служит мерой электронной поляризации, т.е. мерой смещения электронов в молекуле под действием электрического поля. Так как общее смещение электронов в молекуле складывается из смещения электронов отдельных атомов, электронов, участвующих в образовании химических связей и определяющих структуры молекулы, то и молярная рефракция обладает свойством аддитивности, т.е. она складывается из атомных и структурных рефракций:
. По размерности и по физическому смыслу молярная рефракция представляет собой объем, занимаемый молекулами одного киломоля вещества. Она служит мерой электронной поляризации, т.е. мерой смещения электронов в молекуле под действием электрического поля. Так как общее смещение электронов в молекуле складывается из смещения электронов отдельных атомов, электронов, участвующих в образовании химических связей и определяющих структуры молекулы, то и молярная рефракция обладает свойством аддитивности, т.е. она складывается из атомных и структурных рефракций:
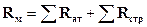 (1.3.)
(1.3.)
При расчете молярной рефракции как аддитивной величины, следует учитывать и ту долю, которую вносят в суммарное значение присутствие двойных или тройных связей (инкременты связей). Чаще при определении строения органических молекул достаточно выяснить вид структуроопределяющего атома. Например, кислород гидроксильный, эфирный, карбонильный или карбоксильный.
Значения некоторых атомных и структурных рефракций приведены в таблице 1.2.
Таблица 1.2.
Атомные и структурные рефракции
| Атом и связь. | R·103, 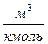
| Атом и связь | R·103, 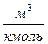
|
| Н | 1,100 | О (в гидроксиле) | 1,525 |
| С | 2,418 | О (в карбониле) | 2,211 |
| Cl | 5,967 | О (в простом эфире) | 1,643 |
| Br | 8,865 | N (третичный) | 2,840 |
| Двойная связь | 1,733 | Тройная связь (С≡С) | 2,398 |
Измерив молярную рефракцию по показателю преломления и пользуясь свойством аддитивности можно сделать вывод о строении молекулы.
Например: эмпирическая (брутто) формула вещества С2Н6О; для него возможны две структурные формулы: СН3―О―СН3 (эфир) и СН3―СН2―ОН (спирт). Измерив молярную рефракцию (Rизм) пользуясь свойством аддитивности находим рефракцию кислорода:
Rизм = 2Rc + 6RH + RO → RO = Rизм--2Rc -6RH (1.4.)
Значение RO сравниваем со значениями рефракции кислорода. Если оно близко к рефракции эфирного кислорода, значит это эфир; если к рефракции гидроксильного кислорода, то – спирт.
Дата добавления: 2015-09-28; просмотров: 1306;
