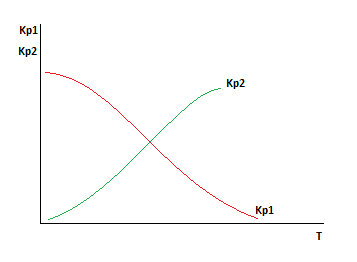
Уравнение скорости реакции, протекающей по законам формальной кинетики
2A+B=2C
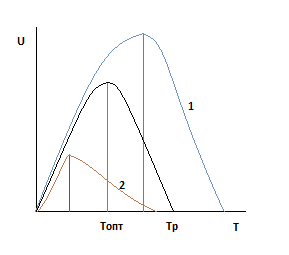
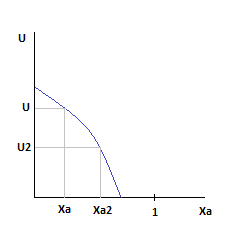
Давление и Ха постоянны.
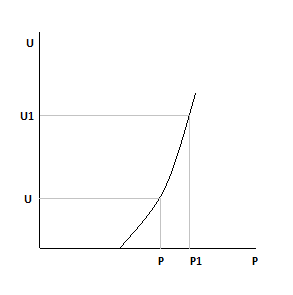
Как изменятся зависимости при:
1)Увеличим давление, Ха=const
2)Увеличим Xa, давление постоянно.
Чтобы проанализировать необходимо оценить влияние давления на скорость реакции для первого случая и влияние давления на оптимальную и равновесную температуры.
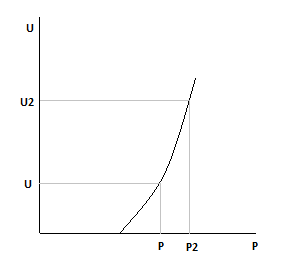
Очевидно, что во всем диапазоне изменения давления увеличение давления приводит и к увеличению скорости.
Выражения для расчета:
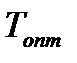 пропорциональна
пропорциональна 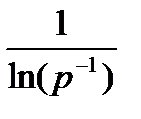
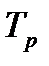 пропорциональна
пропорциональна 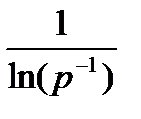
p-1=p2-3
С увеличением давления равновесная и оптимальная температуры растут.
Зависимость будет смещена относительно базовой.
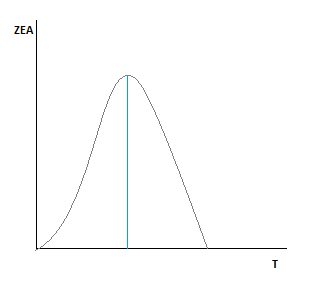
Зависимость скорости от степени превращения ключевого компонента.
По мере роста Ха, скорость падает во всем диапазоне изменения степени превращения.
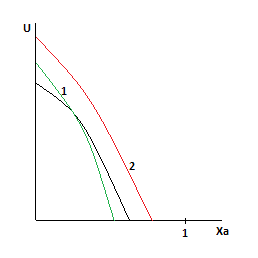 Анализ уравнения для расчета оптимальной и равновесной температур показывает, что с ростом Ха, оптимальная и равновесная температуры падают.
Анализ уравнения для расчета оптимальной и равновесной температур показывает, что с ростом Ха, оптимальная и равновесная температуры падают.
Развернем координатную сетку.
T,P=const
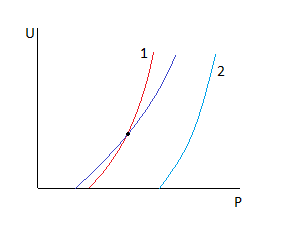
1.Увеличим T, P=const
2.Увеличим P, T=const
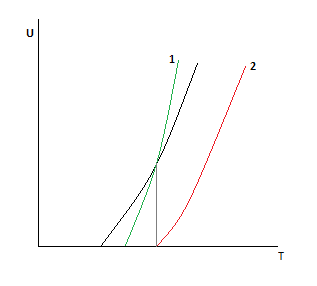
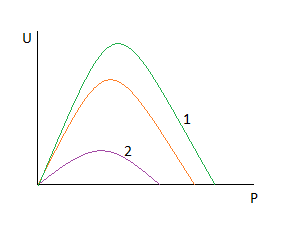
Рассмотрим точку пересечения.
До нее k резко растет, а движущая сила падает.
После неё движущая сила падает, а k растет, но скорость стремится к 0. 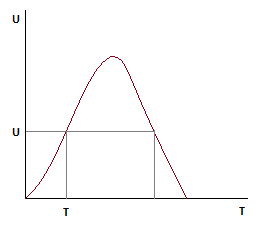
2) Увеличиваем давление, следовательно X*Ea тоже растет.
С увеличением давления скорость химической реакции растет.
Рассмотрим эндотермическую реакцию:
А=В+С
1) Давление растет при постоянной степени превращения;
2) Степень превращения растет при постоянном давлении.
Пересечение говорит о том, что есть температура, при которой скорость не зависит от давления.
Для увеличения скорости реакции необходимо увеличить давление в определенном диапазоне. В результате получаем зависимость с пересечением.

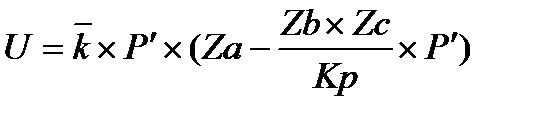
С увеличением давления выражение в скобках падает, таким образом получаем противоречие.
Задание1 Экзотермическая реакция.
2А+В=2С
1.Увеличиваем температуру, степень превращения постоянна.
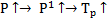
2.Степень превращения растёт, температура постоянна.
Задание 2 Эндотермическая реакция.
A=B+C
1.Увеличиваем температуру, степень превращения постоянна.
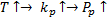
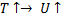
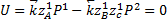
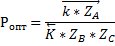
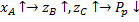
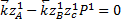
Функция проходит через максимум.
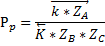
2.Увеличиваем степень превращения, температура постоянна.

Реальные процессы
CH3OH↔CO+2H2
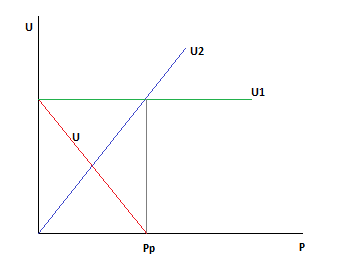
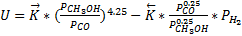
Это эмпирическое уравнение скорости реакции разложения метанола (имеет место в метанольных топливных элементах).
Такое уравнение для суммарной скорости реакции связано с тем, что СО адсорбируется на поверхности катализатора.
Проанализируем как будет зависеть скорость процесса от давления при постоянных температуре и степени превращения метанола.
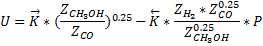
Степень превращения и температура постоянны. Вычитая из прямой скорости реакции обратную получим, что для данной реакции наблюдается уменьшение суммарной скорости реакции с ростом давления. То есть для данной реакции отсутствует понятие оптимальное давление, а любое увеличение давлении выше атмосферного приведёт к уменьшению суммарной скорости реакции.
Управление состоянием равновесия и скоростью сложных процессов.
Если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то направление процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении.
А) Влияние давления.
Характер влияния давления на равновесие химической реакции определяется знаком разности числа молей газообразных участников реакции или знаком изменения объема. Для газовых реакций, в которых число молей продуктов превышает число молей реагентов увеличение давления неблагоприятно. Смешению равновесия вправо способствует уменьшение давления. Если же реакция протекает с уменьшением числа молей, то повышение давления целесообразно, так как оно сместит равновесия в сторону продуктов реакции.
Б) Влияние концентрации.
В соответсвии с принципом Ле-Шателье введение в равновесную систему дополнительных количеств какого-либо вещества вызывает смещение равновесия в том направлении, при котором концентрация этого вещества уменьшается. Поэтому введение избытка исходных веществ смещает равновесие вправо; введение избытка продукта вызовет смещение равновесия влево.
В) Влияние температуры.
Направление смещение равновесия при изменении температуры зависит от знака теплового эффекта реакции. Повышение температуры всегда благоприятствует накоплению веществ, обазующихся в данной реакции с поглощением теплоты, то есть усиливает эндотермическое направление реакции. Понижение температуры действует в противоположную сторону, то есть усиливает экзотермическое направление.
Предположим, что в реакторе могут одновременно протекать 2 реакции(параллельные).
a1A+b1B=cC
a2A+b2B=dD
Для расчёта материального баланса равновесной смеси необходимо составить материальный баланс исходной смеси и установить связь между начальными мольными долями компонентов и равновесной степенью превращения ключевого компонента.
a1A+b1B=cC
a2A+b2B=dD
| a1A+b1B=cC a2A+b2B=dD | ∑ | ||||
| Исходные вещества | ZNA | ZNB | |||
| Производи-тельность | -ZNA*X1 -ZNA*X2 | 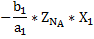
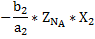
| 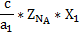
|
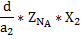
| 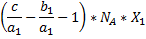
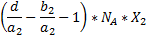
|
| Конечные вещества | 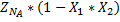
| 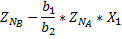
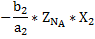
| 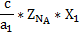
| 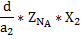
| w |
Примем, что суммарный мольный поток равен единице.
Для упрощения таблица примем,что мольные доли продуктов в исходной смеси равны нулю.
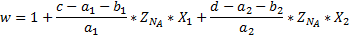
Для расчёта мольных долей компонентов в конечной смеси нужно разделить мольный поток каждого компонента на коэффициент изменения числа молей.
Для расчёта равновесного состава составим систему из двух уравнений:

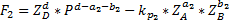
Для нахождения X1 и X2 надо решить систему трансцендентных уравнений с условием
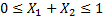
При любой температуре
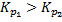
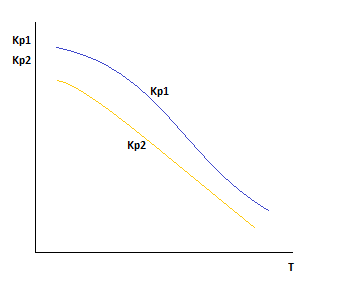
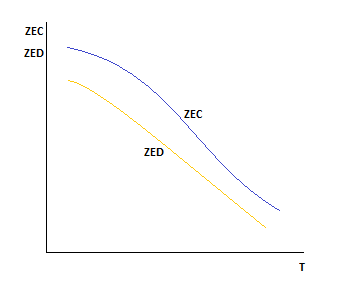 Для выполнения равенства F1 и F2=0.Необходимо, чтобы концентрация вещества С была больше концентрации компонента D.
Для выполнения равенства F1 и F2=0.Необходимо, чтобы концентрация вещества С была больше концентрации компонента D.
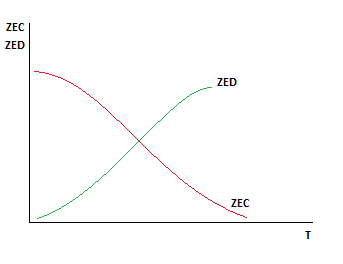
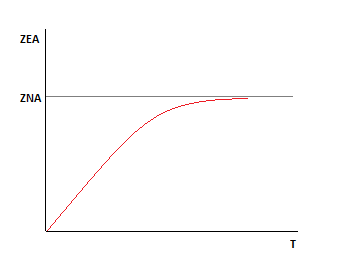
Раздел 2
Дата добавления: 2015-11-12; просмотров: 1118;
