Скорость необратимых реакций
В кинетических уравнениях приводятся концентрации и парциальные давления.
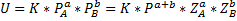
Надо подобрать такие параметры, чтобы U была максимальной.
Например реакция без изменения числа молей:
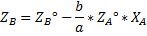
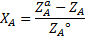
Есть процессы, которые идут близко к равновесным (синтез олеума серной кислоты).
U=f(T,P,XA)
Рассмотрим данную зависимость для необратимых реакций(три случая).
1.U=f(T) P,XА (степень превращения по целевому компоненту)-const.
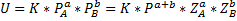
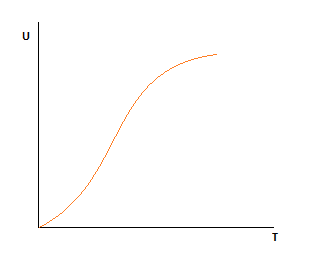 Где
Где 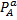 и
и 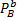 -парциальные давления компонентов А и В.
-парциальные давления компонентов А и В.
С ростом температуры возрастает энергия молекул, следовательно суммарная скорость реакции возрастает.
 2. U=f(P) T,XА –const.
2. U=f(P) T,XА –const.
Повышение давления эквивалентно увеличению концентрации, следовательно увеличивается суммарная скорость реакции.
3. U=f(XA) T,P –const.
-
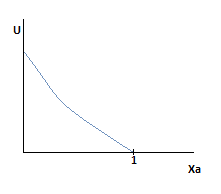 Уменьшается движущая сила, следовательно суммарная скорость падает.
Уменьшается движущая сила, следовательно суммарная скорость падает. - С увеличением степени превращения снижаются концентрации действующих реагентов, следовательно суммарная скорость реакции падает.
Пример: P=const
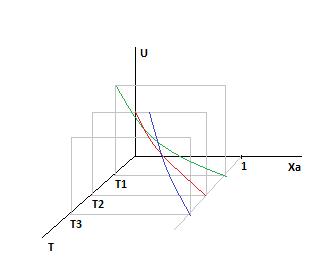
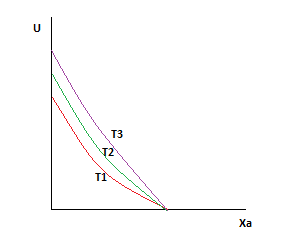
Так как с ростом температуры суммарная скорость возрастает, то следующая кривая будет выше предыдущей.
Рассмотрим данную зависимость для обратимых реакций(три случая).
ν
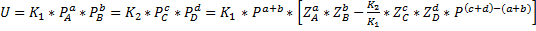
ДС
Где 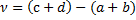 -коэффициент приведенного количества вещества.
-коэффициент приведенного количества вещества.
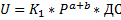 , где ДС-движущая сила обратимой реакции.
, где ДС-движущая сила обратимой реакции.
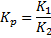
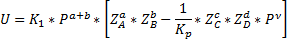
ДС- термодинамический параметр, а U-кинетический параметр.
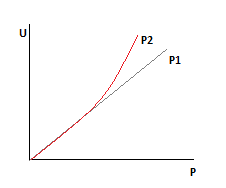
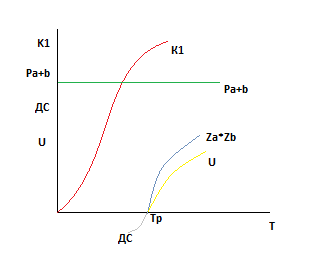
1). U=f(T) P,XА -const.
a. ∆G0>0 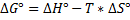
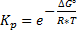
Для эндотермической реакции
Причина роста U для эндотермической реакции с ростом температуры заключается в том,что с ростом температуры возрастает движущая сила реакции.
b. 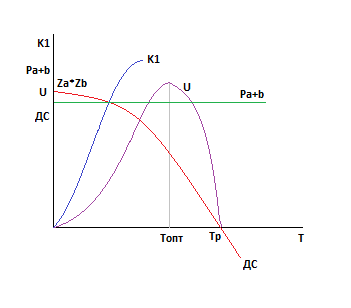 ∆G0<0
∆G0<0
Дата добавления: 2015-11-12; просмотров: 945;
