Влияние концентрации фермента на скорость ферментативной реакции.
Концентрация фермента оказывает существенное влияние на скорость ферментативной реакции. При насыщающей концентрации субстрата, обеспечивающей Vmax, начальная скорость ферментативной реакции будет, в первую очередь, зависеть от концентрации фермента. Эта зависимость прямо пропорциональная, что свидетельствует о том, что начальная скорость является мерой количества фермента. Графически это представлено на рис. 8.5.
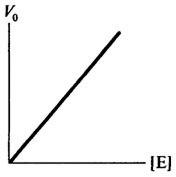
Рис. 8.5. Влияние концентрации фермента [E] на скорость ферментативной реакции (V0)
Влияние температуры на активность ферментов.Общий вид кривой, характеризующей влияние температуры на активность фермента, можно представить в виде графика, изображенного на рис. 8.6.
Оптимальная температура, при которой наблюдается максимальная активность, для большинства ферментов находится в пределах 37-50 0C, но некоторые ферменты имеют температурный оптимум за пределами этой зоны.
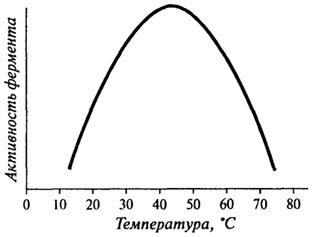
Рис. 8.6. Влияние температуры на активность фермента
Влияние температуры на активность фермента, которое может быть легко изучено экспериментально, имеет очень сложный характер, так как обусловлено целым рядом факторов, а именно:
- влиянием температуры на скорость расщепления комплекса ES на свободный фермент и продукт реакции, т. е. на константу скорости реакции
- влиянием температуры на сродство фермента к субстрату, то есть на константы k+1 и k_,;
- влиянием на теплоту ионизации, а, следовательно, на процессы ионизации всех компонентов реакции: самого фермента, субстрата, промежуточных и конечных продуктов реакции;
- влиянием на образование таких соединений, как "фермент-активатор" или "фермент-ингибитор";
- влиянием на процесс денатурации ферментного белка.
Известное уравнение Аррениуса, характеризующее влияние температуры на скорость химической реакции, может быть приложено к левой части температурной кривой (см. рис. 8.6):
| d ln k |
| dT |
=
| E |
| RT2 |
где k - константа скорости реакции; T- абсолютная температура, °К; E- энергия активации; R - универсальная газовая постоянная.
Изменение скорости ферментативной реакции при повышении температуры измеряется температурным коэффициентом Q10, который показывает, во сколько раз ускоряется данная реакция при повышении температуры на десять градусов. Можно преобразовать уравнение Аррениуса, подставив в него коэффициент Q10:
E =
| RT2InQ |
Это уравнение дает возможность определить энергию активации путем определения значений Q10 для данной ферментативной реакции.
Для обычных химических реакций Q10= 2-3, для ферментативных реакций (левая часть температурной кривой) Q10= 1-2, причем значение Q10= 1 характерно для температур, близких к оптимальным.
Правая часть температурной кривой показывает резкое снижение скорости ферментативной реакции при температурах, превышающих оптимальную. И это зависит, в первую очередь, от денатурации ферментного белка. Поэтому очень важным показателем, характеризующим отношение фермента к температуре, является его термостабильность.
Термостабильность фермента складывается как бы из двух критериев: величины температуры и времени ее воздействия на фермент. Кроме того, на термостабильность различных ферментов могут оказывать влияние и такие факторы, как рН среды, ее солевой состав, защитное действие субстрата.
Влияние рН на активность ферментов.Для каждого фермента характерна определенная узкая область значений рН, при которой он проявляет максимальную активность.
Форма кривых, описывающих зависимость активности фермента от рН, отражает способность важных для данного фермента протон-донорных или протон-акцепторных групп в активном центре фермента переходить в состояние с требуемой степенью ионизации при определенных значениях рН (см. рис. 8.7).
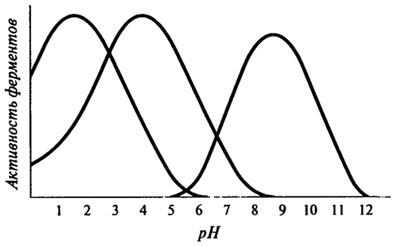
Рис. 8.7. Кривые, характеризующие зависимость активности фермента от рН
Кроме влияния рН на состояние ионизации активного центра фермента, ход представленных кривых будет зависеть и от других факторов. В частности, изменение рН среды изменяет состояние ионизации субстрата (если это заряженное вещество), комплексов ES и EP, в некоторых, например, окислительно-восстановительных реакциях, ионы H+
сами могут принимать участие в реакции; помимо этого, скорость денатурации ферментативного белка зависит от рН.
При экспериментальном изучении активности фермента от рН следует помнить, что рH-оптимум зависит от состава среды (от природы используемого буфера); оптимумы рН прямой и обратной реакции могут быть совершенно различными; при действии одного и того же фермента на различные субстраты рН-оптимумы также могут быть различными. Кроме понятия оптимума рН, очень важным является понятие рН-стабильности. Это тот диапазон рН, при котором фермент или ферментативный препарат сохраняет свою активность в течение определенного периода времени. рН-Стабильность также зависит от ряда факторов, среди которых, кроме уже названных, форма ферментного препарата, степень его очистки и др.
Все выше сказанное позволяет утверждать, что варьируя температурный режим и изменяя рН, можно в какой-то мере регулировать каталитическую активность фермента.
Влияние активаторов и ингибиторов.Активаторами называют вещества, которые повышают активность ферментов. Хорошим примером таких соединений являются аминокислота цистеин и восстановленный глутатион, содержащие свободную SH-группу. Их активирующее действие заключается в том, что они восстанавливают дисульфидные связи с образованием SH-групп, необходимых для проявления каталитической активности тиоловых ферментов. Кроме того, некоторые ферменты активируются металлами, которые либо участвуют в построении активного центра, либо стабилизируют пространственную конформацию ферментного белка и тем самым обеспечивают проявление каталитических функций.
Ингибиторами называют вещества, специфически снижающие активность ферментов. Снижение или полная потеря активности ферментов могут быть вызваны разного рода денатурирующими воздействиями, в этом случае правильнее употреблять термин "инактивация" фермента.
Механизм действия ингибиторов может быть самым разнообразным:
- ингибитор взаимодействует с апоферментом, при этом возможны такие варианты, как связывание функциональных групп белка, изменение третичной и четвертичной структуры апофермента, специфическое связывание с определенным участком апофермента, неспецифическая адсорбция на белке;
- ингибитор образует комплекс с субстратом;
- ингибитор связывает кофермент;
- ингибитор связывает активатор;
- ингибитор связывает кофактор.
Чаще всего ингибитор взаимодействует с ферментом, образуя комплекс. Это можно выразить следующим уравнением:
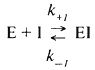
Константа диссоциации комплекса фермент-ингибитор (или константа ингибирования) Ki.определяется выражением:
ki =
| k+1 |
| k-1 |
=
| [E]·[S] |
| [EI] |
Кi прямо пропорциональна концентрации фермента и ингибитора и обратно пропорциональна концентрации комплекса фермент-ингибитор.
Существует ингибирование двух основных типов: необратимое и обратимое. Теоретически, в случае необратимого ингибирования k-1 = 0, то есть комплекс EI настолько прочен, что совершенно не диссоциирует. Но для большинства необратимых ингибиторов величина k-1_, хотя и очень мала, но не равна нулю.
Обратимое ингибирование, в свою очередь, бывает конкурентным и неконкурентным.
Конкурентный ингибитор конкурирует с субстратом на основе структурного сходства, связываясь с активным центром фермента с образованием неактивного комплекса фермент-ингибитор. Отличительная особенность конкурентного ингибирования состоит в том, что его можно устранить или ослабить, повысив концентрацию субстрата. Конкурентный ингибитор снижает сродство фермента к субстрату, следовательно, величина Кm в присутствии конкурентного ингибитора увеличивается.
Графически это выглядит так, как изображено на рис. 8.8
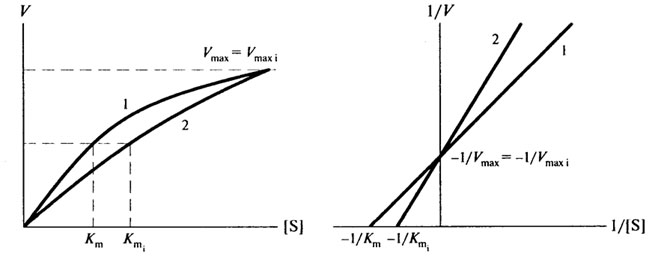
Рис. 8.8.Конкурентное ингибирование: 1- без ингибитора; 2- с конкурентным ингибитором
При неконкурентном торможении ингибитор связывается не с активным центром фермента (то есть не там, где присоединяется субстрат), а с другим участком молекулы фермента. Очевидно, что в этом случае ингибитор не оказывает влияние на величину константы Михаэлиса Кт, но будет снижать максимальную скорость реакции - Vmax
Графически это можно изобразить следующим образом (см. рис. 8.9):
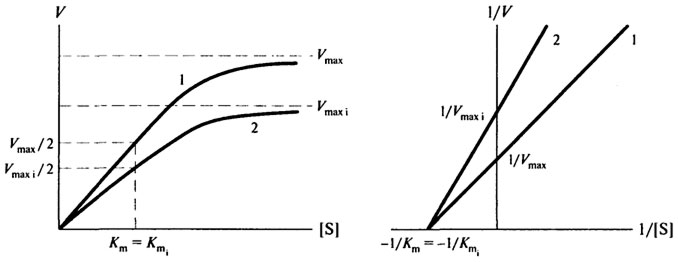
Рис. 8.9.Неконкурентное ингибирование:1- без ингибитора; 2-е неконкурентным ингибитором
Одними из самых распространенных неконкурентных ингибиторов являются аллостерические ингибиторы. Присоединяясь не к активному, а к другому, так называемому аллостерическому центру молекулы фермента, ингибитор вызывает конформационные изменения в структуре активного центра, вследствие чего становится невозможным образование комплекса фермент- субстрат.
Изучение взаимодействия ферментов с ингибиторами и активаторами ферментов позволяет получать ценные сведения о субстратной специфичности ферментов, природе функциональных групп активного центра, механизмах каталитической активности.
Так как в качестве ингибиторов могут выступать конечные продукты реакции, различные промежуточные продукты метаболизма, нет сомнения в той огромной роли, которую выполняют ингибиторы в регуляции ферментативной активности.
Это подтверждает и факт широкого распространения ингибиторов белковой природы (см. гл. 2). Кроме того, по принципу специфического ингибирования действуют многие лекарственные препараты, антибиотики, токсичные вещества, антиалиментарные факторы питания.
Специфические ингибиторы, встречающиеся в пищевом сырье и пищевых продуктах, присутствуют в качестве составляющих как в традиционных рецептурах, так и в сложных композиционных составах
новых, модифицированных продуктов питания. Поэтому нельзя не учитывать их влияние на активность отдельных ферментов и на биохимические процессы в целом, протекающие при хранении и переработке пищевого сырья.
Все это лишний раз говорит о множестве сложных проблем, которые встречаются в экспериментальной работе с ферментами и использовании ферментных препаратов на практике.
281 :: 282 :: 283 :: 284 :: 285 :: 286 :: 287 :: 288 :: 289 :: 290 :: 291 :: 292 :: 293 :: 294 :: 295 :: Содержание
295 :: 296 :: 297 :: 298 :: Содержание
Дата добавления: 2015-11-18; просмотров: 2321;
