Сравнение эффективности реакторов идеального смешения и идеального вытеснения в изотермическом режиме.
При одинаковых условиях проведения одной и той же реакции для достижения равной глубины превращения среднее время пребывания реагентов в проточном реакторе идеального смешения больше, чем в реакторе идеального вытеснения. Этот факт может быть легко объяснён характером распределения концентрации реагентов по объёму указанных реакторов. Если в проточном реакторе идеального смешения концентрации во всех точках равны конечной концентрации( линия 1), то в реакторе идеального вытеснения в двух соседних точках на оси реактора концентрации реагентов уже отличаются (линия 2). Например, в случае реакции первого порядка формула распределения концентрации реагента А по длине реактора идеального вытеснения будет иметь вид
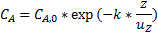
Скорость реакции, согласно закону действующих масс, пропорциональна концентрации реагентов. Следовательно, в РИВ она всегда выше, чем в проточном РПС. А при большей скорости протекания реакции для достижения той же глубины превращения требуется меньшее время пребывания реагентов в реакторе.
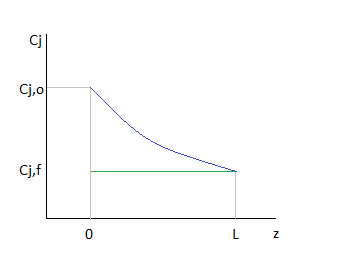
Более наглядно можно проиллюстрировать, сравнивая среднее время пребывания реагентов в проточных реакторах как площади геометрических фигур.
Сравним эффективность работы идеальных проточных реакторов для случая проведения в них простых реакций, не осложненных побочными взаимодействиями. Зададимся одинаковой степенью превращения исходного реагента и будем считать более эффективным тот реактор, в котором для достижения заданных результатов требуется меньшее среднее время пребывания 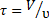
Для проточного РПС при заданной глубине превращения среднее время пребывания можно определить как произведение двух постоянных величин:
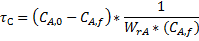
или
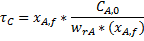
То есть геометрически представить в виде прямоугольника с соответствующими сторонами.
Для стационарного режима идеального вытеснения:
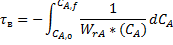
Или
r wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>"> 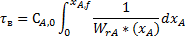
То есть величина 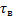 как определённый интеграл выражается геометрически площадью криволинейной трапеции.
как определённый интеграл выражается геометрически площадью криволинейной трапеции.
Площади криволинейных трапеций, соответствующие 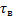 , меньше площадей прямоугольников, соответствующих
, меньше площадей прямоугольников, соответствующих 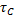 , причём разница тем больше, чем больше достигаемая в реакторе степень превращения исходного реагента. Следовательно, при равном объёмном расходе для достижения одинаковых результатов реактор идеального вытеснения должен иметь меньший объём, чем проточный реактор смешения. Интенсивность работы реактора идеального вытеснения
, причём разница тем больше, чем больше достигаемая в реакторе степень превращения исходного реагента. Следовательно, при равном объёмном расходе для достижения одинаковых результатов реактор идеального вытеснения должен иметь меньший объём, чем проточный реактор смешения. Интенсивность работы реактора идеального вытеснения
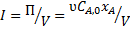
будет выше. Объяснить это можно более высокой скоростью реакции в реакторе вытеснения вследствие более высокой концентрации реагентов.
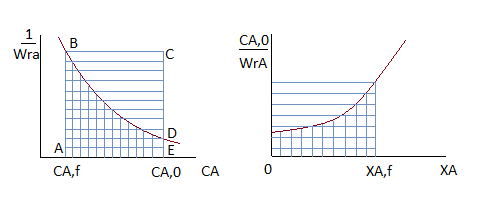
Однако не всегда стремятся к поддержанию более высоких концентраций исходных реагентов. При проведении параллельных реакций разного порядка в том случае, если порядок целевой реакции меньше порядка побочной реакции при низких концентрациях исходных реагентов обеспечиваются более высокие значения дифференциальной селективности. Если порядок целевой реакции превышает порядок побочной параллельной реакции, выход целевого продукта выше в РИВ. При этом и среднее время пребывания для достижения заданной степени превращения реагентов меньше, чем в РПС.
Если порядок целевой реакции меньше порядка побочной реакции, более высокое значение выхода целевого продукта достигается в РПС. Однако в рассматриваемом случае, то есть при одинаковой степени превращения исходного реагента, среднее время пребывания в реакторе идеального смешения больше, чем в РИВ.
Если целевая и побочная реакции имеют одинаковый порядок, выход целевого продукта при равной степени превращения исходного реагента не зависит от типа выбранного реактора.
Для достижения высокого выхода целевого продукта эффективнее РИВ, а иногда РПС. При этом следует отметить, что даже при достижении более высокого выхода целевого продукта при равной степени превращения РПС имеет больший объём, чем РИВ.
Задание 3 Обратимая реакция.
А=С+2D
Эндотермическая обратимая реакция.
1. 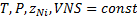
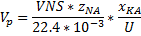
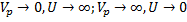
2. 
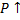
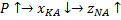
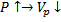
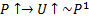
Задание 4 Необратимая эндотермическая реакция.
2A=C+D
1. 
2. 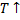
Задание 5 Реакция без изменения объёма.
Увеличение давления для такой реакции не влияет на её скорость.
Адиабатический температурный режим
Рассмотрим реактор типа РПС (в качестве элементарного объёма выступает весь объём реактора).
Составим тепловой баланс для всего реактора в целом (реактор работает в стационарных условиях).
Уравнение теплового баланса реактора типа РПС (в адиабатических условиях):
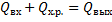
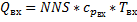
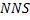 -начальный мольный поток.
-начальный мольный поток.
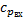 -теплоёмкость смеси на входе в реактор.
-теплоёмкость смеси на входе в реактор.
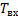 -температура смеси на входе в реактор.
-температура смеси на входе в реактор.
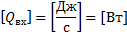
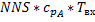
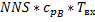
Расчленим по компонентам
∑
Считаем, что 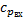 -средняя теплоёмкость на входе в реактор.
-средняя теплоёмкость на входе в реактор.
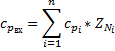
Учитываются все компоненты, поступившие в реактор.
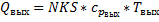
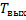 -неизвестна.
-неизвестна.
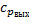 не вычислить, так как
не вычислить, так как 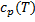 .
.
Примем допущение, что 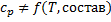 .
.
Это допущение вносит незначительную долю ошибки в расчет.
Молярная теплоёмкость веществ ( 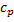 ) в газообразной форме отличается друг от друга незначительно, поэтому изменение состава не приведёт к существенному изменению средней теплоёмкости.
) в газообразной форме отличается друг от друга незначительно, поэтому изменение состава не приведёт к существенному изменению средней теплоёмкости.
Зависимость 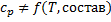 вносит значительную ошибку, но в уравнении скорости процесса в константе равновесия учтена температурная зависимость.
вносит значительную ошибку, но в уравнении скорости процесса в константе равновесия учтена температурная зависимость.
Поэтому 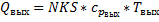
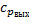 -средняя теплоёмкость смеси на выходе из реактора.
-средняя теплоёмкость смеси на выходе из реактора.
Так как 
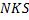 неизвестна, но мы знаем, что
неизвестна, но мы знаем, что 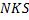 связанна с коэффициентом изменения числа молей смеси, а он учитывает приращение концентрации компонентов, входящее в уравнение скорости процесса, то для первоначального рассмотрения можно принять:
связанна с коэффициентом изменения числа молей смеси, а он учитывает приращение концентрации компонентов, входящее в уравнение скорости процесса, то для первоначального рассмотрения можно принять:
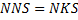
Тогда
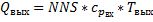
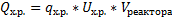
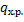 -удельный тепловой эффект химической реакции.
-удельный тепловой эффект химической реакции.
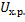 -скорость реакции.
-скорость реакции.
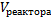 - объём реактора.
- объём реактора.
Автоматическое определение знака:
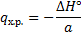
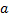 - коэффициент при ключевом компоненте.
- коэффициент при ключевом компоненте.
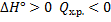
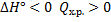
Закон Гесса (определение теплового эффекта химической реакции):
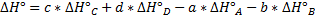
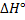 берём при 298К.
берём при 298К.
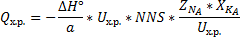
Так как мы рассматриваем неравновесное состояние( 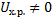 ).
).
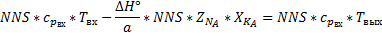
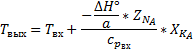
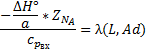 -Адиабатический коэффициент.
-Адиабатический коэффициент.
Физический смысл адиабатического коэффициента - изменение температуры реакционной смеси при полном превращении ключевого компонента.
Вывод уравнения теплового баланса для реактора типа РИВ
Адиабатическая модель РИВ:
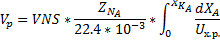
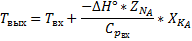
Адиабатическая модель РПС:
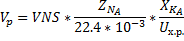
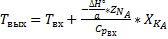
Проектирование РИВ:
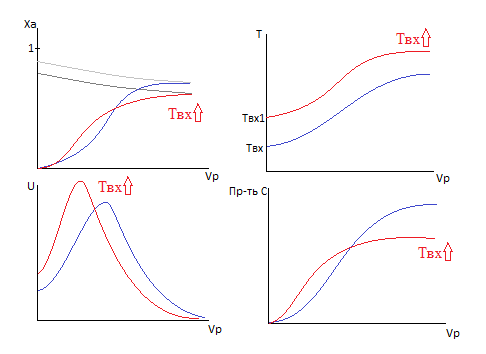
Рассмотрим экзотермическую реакцию.
1.
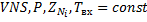
Температура не является управляющим параметром.
Управляющим параметром является температура на входе в реактор.
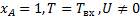 , остальные параметры равны нулю на входе в реактор.
, остальные параметры равны нулю на входе в реактор.
Так как 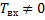 , следовательно,
, следовательно, 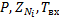 будет соответствовать некоторое значение равновесной степени превращения.
будет соответствовать некоторое значение равновесной степени превращения.
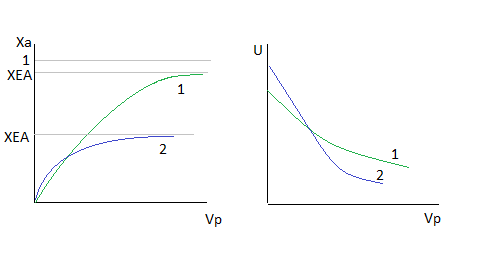
Так как реакция является экзотермической, то при увеличении температуры в соответствии с принципом Ле-Шателье равновесие смещается в сторону исходных веществ, то есть по мере протекания реакции равновесие смещается в сторону исходных веществ, то есть скорость стремится к нулю, а производительность - к предельному значению.
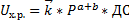
Поскольку при протекании реакции температура возрастает один из сомножителей в уравнении скорости (константа скорости растёт, а движущая сила процесса падает), причём движущая сила уменьшается по двум признакам: увеличение температуры приводит к уменьшению константы равновесия, а изменение концентрации реагентов (исходных веществ увеличивается, а продуктов уменьшается) приводит к снижению концентраций, составляющих ДС. Следовательно, скорость проходит через экстремум, то есть когда рост константы скорости превышает рост убывание ДС, то мы находимся в состоянии вдали от равновесия, а если ДС мала, то величина константы скорости не имеет значения.
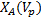 -вогнуто-выпуклая кривая. Точка перегиба- максимум скорости.
-вогнуто-выпуклая кривая. Точка перегиба- максимум скорости.
2.Температура на входе в реактор растёт.
Рост скорости существенен, а затем резко снижается.
Отсюда следует, что при проведении обратимой экзотермической реакции увеличение входной температуры выгодно только в том случае, если реакцию проводят вдали от равновесия.
Для модели РИВ объёмы реактора, при которых наблюдаются пересечение степени превращения и скорости не совпадают.
Связано это с тем, что в соответствии с 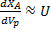 дифференциальной формой уравнения материального, баланса производная от
дифференциальной формой уравнения материального, баланса производная от 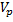 пропорциональна скорости, следовательно, в точке пересечения тангенс угла наклона касательных разный.
пропорциональна скорости, следовательно, в точке пересечения тангенс угла наклона касательных разный.
Для адиабатического РПС характер зависимостей при проведении процесса в адиабатическом режиме аналогичны РИВ, за исключением случая, когда в РПС наблюдаются зоны множественности стационарных состояний.
Применимо к сравнению реакторов, работающих в адиабатическом режиме можно использовать следующую методику:
Надо сравнить среднюю скорость в РИВ и РПС. Для этого сравним ДС РИВ и РПС. Очевидно, что в соответствии с допущениями, которые мы делали для моделей:
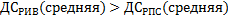
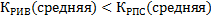
Вывод: При проведении экзотермической обратимой реакции в РПС будем предпочтительней в том случае, если процесс проводится вдали от состояния равновесия, а РИВ- если процесс проводится вблизи равновесия, то есть для обеспечения высокой скорости процесса более выгоден РПС, а если необходимо обеспечить высокую степень превращение, то выгоден РИВ.
Дата добавления: 2015-11-12; просмотров: 5136;
