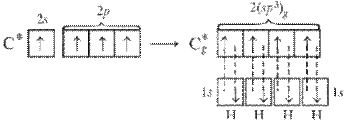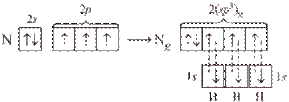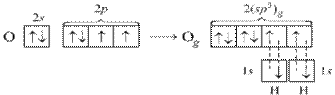Задание 3 контрольной работы
Для химического элемента: определить в какой группе и каком периоде Периодической таблицы находится, к какому семейству относится, записать электронную формулу для нормального и возбужденного состояния атома, перечислить валентные электроны и возможные степени окисления, привести примеры соединений элемента в этих степенях окисления.
| Номер задания
| Химический элемент
| Номер задания
| Химический элемент
| Номер задания
| Химический элемент
|
|
| 5B
|
| 56Ba
|
| 19K
|
|
| 79Au
|
| 32Ge
|
| 82Pb
|
|
| 56Ba
|
| 105Db
|
| 40Zr
|
|
| 55Cs
|
| 34Se
|
| 39Y
|
|
| 67Ho
|
| 48Cd
|
| 30Zn
|
|
| 66Dy
|
| 50Sn
|
| 81Tl
|
|
| 74W
|
| 46Pd
|
| 20Ca
|
|
| 56Ba
|
| 52Te
|
| 103Lr
|
|
| 16S
|
| 44Ru
|
| 84Po
|
|
| 62Sm
|
| 37Rb
|
| 38Sr
|
| | | | | | | |
Тема 4 Химическая связь
Химическая связь – это взаимное сцепление атомов в молекуле в результате перекрывания их электронных облаков. Образованию химической связи может предшествовать гибридизация АО: преобразование различающиеся по форме и энергии АО разных подуровней в такое же количество гибридных молекулярных орбиталей. Гибридные орбитали имеют одинаковую энергию и форму, что обеспечивает равноценность образующихся связей. Гибридные орбитали более вытянуты в направлении образования химической связи и обеспечивают лучшее перекрывание с орбиталями присоединяющегося атома, чем негибридизованные. В гибридизации могут участвовать и d-орбитали внешнего или предвнешнего квантового уровня. Тип гибридизации АО центрального атома определяет геометрическую форму образующихся молекул или ионов.
Таблица 4
Форма молекул и тип гибридизации центрального атома
| Гибридизация центрального
атома
| Геометрическая форма
молекулы или иона
| Угол между
связями
| Пример молекулы или иона
|
| sp
| Линейная
| 180°
| BeF2, CH≡CH, [Ag(NH3)2]+
|
| p2
| Угловая
| 90°
| H2S, TeCl2
|
| sp3
| Угловая
| ~109,5°
| H2O
|
| sp2
| Плоский треугольник
| 120°
| BF3, CO32–
|
| sp2
| Плоский прямоугольник
| 120°
| CH2=CH2
|
| sp3
| Тетраэдр
| 109,5°
| CH4, NH4+
|
| d 3s
| Тетраэдр
| 109,5°
| TiCL4
|
| sp3
| Тригональная пирамида
| ~109,5°
| NH3, Н3О+, SО32–
|
| sp3d
| Тригональная бипирамида
| 90°, 120°
| PCl5,
|
| sp3d2
| Октаэдр
| 90°
| SF6, [АlF6]33–
|
| d2sp3
| Октаэдр
| 90°
| [Fе(СN)6]4–
|
| dsp2
| Плоский квадрат
| 90°
| [PdСl4]2–
|
Рассмотрим образование молекул с разным типом гибридизации центрального атома.
При образовании молекулы ВеF2 атом бериллия переходит в возбужденное состояние и имеет два неспаренных электрона один на 2s- и один на 2р-орбитали. Гибридизация этих АО приводит к образованию двух sp-гибридных молекулярных орбиталей, расположеных в молекуле под углом 180°, поскольку в таком случае электроны на этих орбиталях испытывают наименьшее взаимное отталкивание. В результате молекула ВF2 имеет линейное строение. Молекула неполярна. В молекуле две равноценные σ-связи Be–F, π-связей нет. Связи полярны, электронная плотность смещена к более электроотрицательному атому F. На рисунке для атомов F показаны только 2р-электроны, образующие связи.
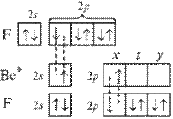
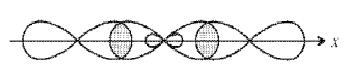
Рисунок 2 Молекула BeF: а) sp-гибридизация АО бериллия и образование двух σ-связей; б) пространственное строение молекулы
При образовании молекулы ВF3 три неспаренных электрона атома бора в возбужденном состоянии расположены на АО 2s, 2рх, 2рz. В результате гибридизации образуются три гибридные sp2-орбитали. Для достижения минимального отталкивания гибридные орбитали направлены в углы правильного треугольника, углы между орбиталями равны 120°. В результате молекула ВF3 имеет форму плоского треугольника, ядро атома бора располагается в центре. Молекула ВF3 неполярна. В молекуле три σ-связи, все связи равноценны, π-связей нет. Связи полярны, электронная плотность смещена в строну атома F.
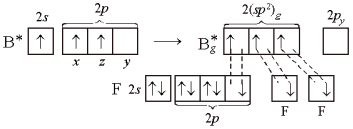
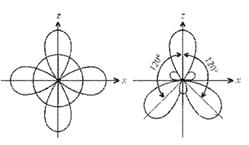
Рисунок 3 Молекула ВF3: а) гибридизация АО бора и образование трех σ-связей; б) ориентация в пространстве исходных атомных 2s-, 2рx- и 2рz-орбиталей; в) ориентация в пространстве гибридных sp2-орбиталей
При образовании связей атомами C, N, О и Cl в гибридизации участвуют одна s-орбиталь и три p-орбитали, во всех случаях образуются четыре sp3-гибридные орбитали, направленные в пространстве от ядра к углам тетраэдра. Углы между орбиталями во всех случаях близки к 109°, однако форма молекул, образуемых этими атомами различны.
В молекуле метана СН4 четыре σ-связи, π-связей нет, связи полярны,электронная плотность смещена к атому С. Форма молекулы тетраэдрическая, молекула неполярна, угол между орбиталями равен 109,46°.
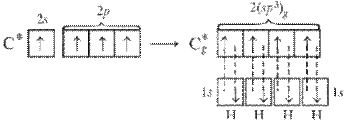
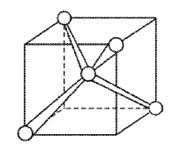
Рисунок 4 Молекула СН4: а) гибридизация АО углерода и образование четырех σ-связей; б) ориентация в пространстве гибридных sp3-орбиталей
В молекуле аммиака NH3 на одной из четырех sp3-гибридных орбиталей азота располагается два спаренных электрона (неподеленная пара электронов), т.е. в молекуле образуется только три σ-связи, π-связей нет. Молекула NH3 имеет форму тригональной пирамиды, в вершине пирамиды – атом азота. Угол между орбиталями составляет 107,8° и отличается от тетраэдрического (109,5°) вследствие более сильного взаимного отталкивания неподеленных электронных пар по сравнению с электронами σ-связи N–Н. Молекула полярна, на атоме азота локализуется частичный отрицательный заряд. Ион аммония NH4+ имеет тетраэдрическое строение.
| NH3 NH4+
тригональная пирамида тетраэдр
| |
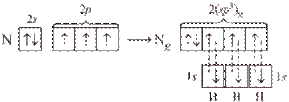
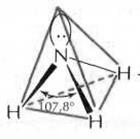
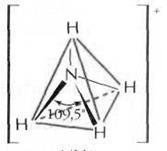
Рисунок 5 Молекула NH3: а) гибридизация АО азота, образование гибридных sp3-орбиталей и трех σ-связей; б) пространственное строение молекулы NH3 и иона NH4+
В молекуле воды Н2О на двух sp3-гибридных орбиталях кислорода располагается неподеленные пары электронов. В молекуле две σ-связи, π-связей нет. Вследствие отталкивания неподеленных электронных пар, угол между связями О–Н отклоняется от тетраэдрического и составляет 104,5°.
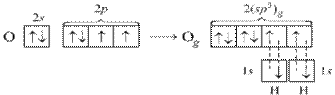
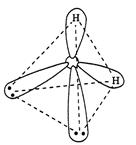
Рисунок 6 Молекула H2О: а) гибридизация АО кислорода, образование гибридных sp3-орбиталей и двух σ-связей; б) пространственное строение молекулы H2О.
При образовании комплексного иона [АlF6]33– в гибридизации участвуют вакантные 3d-орбитали алюминия и образуется шесть гибридных sp3d2-орбиталей, направленных к углам октаэдра. Форма иона октаэдрическая, число σ-связей шесть, угол между связями 90°, π-связей нет.
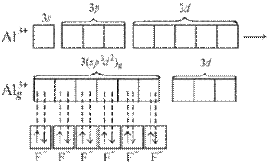
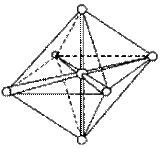
Рисунок 7 Образование иона [АlF6]33– и ориентация sp3d2-гибридных орбиталей
Комплекс [Fе(СN)6]4– тоже имеет октаэдрическую форму, хотя гибридизация d2sp3-типа. Гибридизация с участием d-орбиталей приводит также к квадратной и тетраэдрической формам молекул и ионов.
Дата добавления: 2015-11-10; просмотров: 1025;