Задание 4 контрольной работы
Определить пространственную структуру молекулы, тип гибридизации центрального атома (если есть), число σ- и π-связей, полярность связей и полярность молекулы в целом.
| Вариант | Молекула | Вариант | Молекула | Вариант | Молекула |
| H2O | AsH3 | CO2 | |||
| PH3 | [PtСl4]2– | BeI2 | |||
| Cl2 | BeBr2 | SO2 | |||
| CO32– | SCl6 | H2Te | |||
| NH3 | N2 | HI | |||
| CF4 | SiH4 | I2 | |||
| C2H2 | BCl3 | [АlF6]33– | |||
| SiF4 | H2Se | CCl4 | |||
| OF2 | HBr | AlCl3 | |||
| TiCl4 | C2H4 | COCl2 |
Тема 5 Основные понятия о химической кинетике.
Химическая кинетика изучает протекание химических процессов во времени. Скорость химической реакции зависит от природы реагирующих веществ, их концентрации, температуры, наличия катализатора, гомогенного или гетерогенного состояния реакционной массы.
Гомогенная реакция – протекает во всем объеме, реагирующие вещества и продукты реакции находятся в одной фазе.
Скорость гомогенной химической реакции (υ) – количество вещества Dn, реагирующего или образующегося в единицу времени Dt в единице объема DV реакционного пространства
υ гомо = n/(Vτ)
υ гомо = C/τ
поскольку n/V – это молярная концентрация (С), то
скорость гомогенной реакции – изменение молярной концентрации реагирующего вещества во времени (единица измерения моль·л-1·с-1):
Мгновенная скорость реакции – изменение концентрации (dC) в конкретный момент, т.е. за бесконечно малый отрезок времени
(dt): υмгнов=dC/dt.
Гетерогенная реакция – реакция протекает на границе раздела фаз, реагирующие вещества и (или) продукты реакции находятся в разных фазах.
Скорость гетерогенной реакции зависит от поверхности соприкосновения реагентов – площади раздела фаз (S) (единица измерения моль·м-2·с-1).
Скорость гетерогенной реакции
υгетеро = n/(Sτ).
Скорость химической реакции всегда положительна, знаки «+» или «–» указывают образуется или расходуется вещество в ходе реакции.
Закон действующих масс: Скорость гомогенной реакции пропорциональна произведению молярных концентраций реагирующих веществ (А и В), взятых в степенях, равных стехиометрическим коэффициентам (а,в).
аА + bВ → сС + dD
υ = k[А]а · [В]в , где
k (коэффициент пропорциональности) – константа скорости химической реакции.
Чем больше стехиометрический коэффициент вещества в уравнении, тем больше влияет изменение его концентрации на скорость реакции.
Скорость реакции растет с ростом температуры, поскольку растет скорость молекул и число их активных соударений, приводящих к взаимодействию.
Правило Вант-Гоффа: скорость химической реакции возрастает в 2 ÷ 4 раза при увеличении температуры на 10°.
v2 = v1∙γ(t2- t1)/10, где
v1 – скорость реакции при начальной температуре t1;
v2 – скорость реакции при температуре t2
γ – температурный коэффициент, его значение обычно составляет 2 ÷ 4.
Катализатор – вещество увеличивающее скорость реакции, само не вступает во взаимодействие, в равной степени ускоряет прямую и обратную реакции, не смещает химическое равновесие, приводит к более быстрому его достижению. Количество катализатора значительно меньше, чем реагентов. Катализ гомогенный (катализатор и реагенты в одной фазе) и гетерогенный (в разных фазах).
Обратимые реакции – химические реакции, протекающие одновременно в прямом (®) и обратном () направлениях.
Химическое равновесие – состояние, в котором равны скорости прямой и обратной реакций, концентрации реагентов и продуктов постоянны.
Константа равновесия обратимой химической реакции – отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций реагентов в степени стехиометрических коэффициентов в уравнении, показывает во сколько раз скорость прямой реакции больше скорости обратной реакции.
aA + bB ⇄ сС + dD,
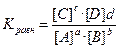 для газов
для газов
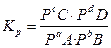 ,
,
где Р- парциальное давление.
Кравн зависит от температуры, природы реагирующих веществ, не зависит от их концентрации. При Кравн>>1 выход продуктов высокий, при Kc<<1 выход продуктов мал, преобладают исходные реагенты.
Изменение хотя бы одного параметра системы приводит к нарушению равновесия и установлению нового равновесия с другими равновесными концентрациями, т.е. смещению равновесия.
Правило Ле Шателье – правило смещения химического равновесия обратимой химической реакции: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие системы сместится в сторону той реакции, которая ослабляет это воздействие.
Пример 1Определите порядок и молекулярность прямой реакции, напишите выражение скорости реакции
а) 2H2O2 (г) = О2(г) + 2H2O (г),
б) S (тв) + O2(г) = SO2 (г).
РешениеПорядок реакции – сумма показателей степени концентраций исходных веществ в уравнении скорости реакции.
а) реакция гомогенная, выражение скорости реакции υа=kа[H2O2]2;
б) реакция гетерогенная, выражение скорости реакции υб=kб[O2].
Реакция а) – второго порядка, реакция б) – первого порядка.
Молекулярность реакции – число молекул, участвующих одновременно в акте химического взаимодействия. Обе реакции двухмолекулярные.
Пример 2Напишите выражения скорости прямой и обратной реакций по закону действующих масс. В сторону прямой или обратной реакции сместится равновесие, при увеличении давления в системе в 3 раза?
а) 2SO3 (г) ⇄ 2SO2 (г) + O2 (г),
б) FeO (тв) + CO (г) ⇄ Fe (тв) + CO2(г).
Решение
а) Реакция а) гомогенная,  υпрям1=kпрям [SO3]2; υобр1=kобр [SO2]2·[O2], где
υпрям1=kпрям [SO3]2; υобр1=kобр [SO2]2·[O2], где
υпрям1 – скорость прямой реакции
υобр1 – скорость обратной реакции
kпрям – константа скорости прямой реакции,
kобр – константа скорости обратной реакции,
[SO3], [SO2] и·[O2] – молярные концентрации реагирующих веществ.
Увеличение давления в 3 раза равноценно увеличению концентраций реагирующих веществ в 3 раза.
υпрям2=k(3[SO3])2=9k[SO3]2=9υпрям1
Скорость прямой реакции возросла в 9 раз.
υобр2=k (3 [SO2])2·(3[O2])=27k[SO2]2·[O2]= 27υобр1
Скорость обратной реакции возросла в 27 раз.
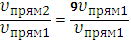
| =9 | 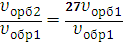
| =27 |
27:9=3 – при увеличении давления в 3 раза равновесие обратимой реакции сместилось в сторону преимущественного протекания обратной реакции.
б) Реакция б) гетерогенная.
Выражение скорости включает только газы:
υпрям1=kпрям [CO], υобр1=kорб [CO2].
Скорости при увеличении давления в 3 раза:
υпрям2=k 3[CO] – скорость прямой реакции возросла в 3 раза
υобр2=k 3 [CO2] – скорость обратной реакции также возросла в 3 раза, т.е.
при увеличении давления смещения равновесия не произошло.
Пример 3 Запишите выражение константы равновесия обратимой реакции. Как надо изменить температуру, давление, концентрацию исходных веществ, чтобы сместить равновесие в сторону прямой реакции
а) 2SO3 (г) ⇄ 2SO2 (г) + O2 (г), ΔH= 384 кДж,
б) 2CO (г) ⇄ CO2 (r) + C (тв), ΔН= -173 кДж?
Решение
Смещение равновесия подчиняется правилу Ле Шателье.
Реакция а) гомогенная, установление равновесия зависит от концентрации всех веществ.
Реакция а)эндотермическая, для смещения равновесия в сторону преимущественного протекания прямой реакции (вправо) необходимо повысить температуру.
Равновесие при понижении давления смещается в сторону образования большего числа молей газов. В прямой реакции газов образуется 2 моля, в обратной – 3 моля. Для смещения равновесия в сторону прямой реакции надо понизить давление в системе, повысить концентрацию SO3, газообразные продукты SO2 и O2 выводить из системы.
Реакция б) гетерогенная, экзотермическая,
Кр = [CO2]/[CO]2
Для смещения равновесия в сторону прямой (экзотермической) реакции необходимо понизить температуру.
Повышение давления вызовет стремление системы ликвидировать избыточное давление за счет образования меньшего количества газов, в результате скорость прямой реакции возрастет по сравнению со скоростью обратной и равновесие сместится в сторону преимущественного протекания прямой реакции. Для смещения равновесия в сторону прямой реакции концентрацию СО надо повышать, а СО2 выводить из системы.
Пример 4При 800С реакция протекает за 16 мин. За какое время закончится реакция а) при 1200С, б) при 600С, если γ=2.
Решение
В решении используем уравнение Аррениуса
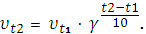
а) 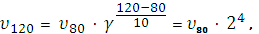
отсюда υ120/ υ80 = 24 = 16,
т. е. при повышении температуры с 800 до 1200С скорость реакции возросла в 16 раз, для проведения реакции потребуется 1 мин.
б) 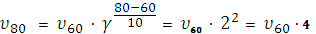 ,
,
отсюда 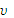 60/
60/ 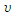 80 = 1/4,
80 = 1/4,
то есть при понижении температуры от 800 до 600С скорость реакции уменьшится в 4 раза, для проведения реакции потребуется 64 мин.
Дата добавления: 2015-11-10; просмотров: 569;
