Тема 3 Строение атома. Химическая связь
Тела, окружающие нас, состоят из веществ, вещества– из молекул. Молекула – наименьшая частица вещества, сохраняющая его химические свойства. Молекулы состоят из атомов. Атом – наименьшая частица химического элемента. Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. Ядро состоит из протонов (р+, заряд +1, масса 1) и нейтронов (n, заряд 0, масса 1). Электроны (е, заряд –1, масса 1836 раз меньше массы протона) создают оболочку вокруг ядра, число электронов в атоме равно числу протонов.
Химический элемент – атомы c одинаковым зарядом ядра, они тождественны по химическим свойствам.
Изотопы – атомы с одинаковым числом протонов, но разным числом нейтронов (отличаются массой). Большинство элементов имеет несколько изотопов, поэтому атомные массы элементов отклоняются от целочисленных значений.
Электрон – микрочастица и имеет двойственную корпускулярно-волновую природу, его движение носит вероятностно-волновой характер.
Атомная орбиталь (АО) – пространство, в котором вероятность нахождения электрона более 90%. Занимая АО, электрон образует электронное облако. Движение электрона по АО характеризуется набором четырех параметров – квантовых чисел (n, l, ml, ms). Три числа характеризуют АО: ее размер и энергию (n), форму (l) и ориентацию в пространстве (ml). Четвертое число (ms) характеризует вращение электрона по АО по или против часовой стрелки.
Главное квантовое число (n) принимает целые значения от 1 до n – номера периода элемента в Таблице Менделеева. Чем ближе АО к ядру, тем меньше n и ниже энергия электрона на этой АО. Электроны с одинаковым значением n образуют энергетический уровень (электронный слой).
Орбитальное квантовое число (l) принимает значения от 0 до (n–1), характеризует подуровни энергетического уровня. АО разных подуровней имеют разную форму. Число подуровней в уровне равно главному квантовому числу уровня.
Так: для n=2 l=0, 1;
для n=3 l=0, 1, 2;
для n=4 l=0, 1, 2, 3.
Орбитали, для которых l = 0, 1, 2, 3,
соответственно называются s-, p-, d-, f-орбиталями,
а электроны, занимающие эти орбитали, s-, p-, d-, f-электронами.
Больше четырех подуровней не заполняется, l = 0,1,2,3 описывают электроны в атомах всех известных элементов.
Магнитное квантовое число (ml) принимает значения (2l+1) и определяет количество и ориентацию орбиталей одного подуровня.
l = 0, ml = 0
l = 1, ml = -1, 0, +1
l = 2 ml = -2, -1, 0, +1, +2
l = 3, ml =-3, -2, -1, 0, +1, +2, +3
Спиновое квантовое число (ms) принимает значение ±1/2, характеризует движение электрона вокруг своей оси (спин). На одной АО может находиться максимально два электрона, у которых числа n, l и ml одинаковы, а числа ms имеют обратные значения (обратные спины).
Так для n=4 числа l и ml могут иметь значения.

| Для l=0, ml имеет одно значение, на энергетическом уровне существует одна s-орбиталь сферической формы. Максимально на s-орбитали располагает 2 электрона. |
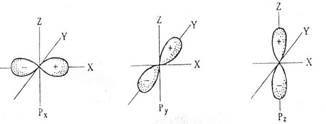
| Для l=1, ml имеет три значения, т.е. на одном уровне существует три р-орбитали. Они имеют форму гантели и ориентированы по осям X, Y и Z. На р-подуровне максимально располагается 6 электронов. |
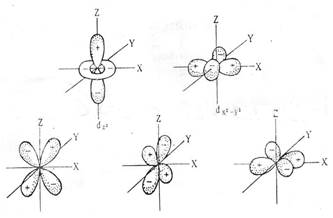
| Для l=2, ml имеет пять значений, т.е. на одном энергетическом уровне существует пять d-орбиталей, их формы, представленны на рисунке. На d-подуровне максимально располагается 10 электронов. |
| Для l=3, ml имеет семь значений, т.е. на одном энергетическом уровне существует семь f-орбиталей, их формы не представлены на рисунке. На f-подуровне максимально располагается 14 электронов. |
Рисунок 1 Форма электронных s-, р-и f-орбиталей
Электроны распределяются по АО в соответствие с правилами:
1. Принцип наименьшей энергии: электроны заполняют орбитали в порядке повышения уровня энергии орбиталей. Для орбиталей одного уровня: Es < Ep < Ed < Ef.
2. Правило Хунда: при заполнении АО электроны располагаются так, чтобы суммарный спин был максимальным: сначала на каждой АО подуровня по одному электрону, затем по второму с противоположными спинами. Суммарный спин спаренных электронов равен нулю.
3. Принцип Паули: в атоме не может быть двух электронов с одинаковыми значения всех четырех квантовых чисел. На одной АО может находиться не более двух электронов с противоположными спинами. Максимальное число электронов на уровне равно 2n2.
4. Правило Клечковского: подуровни заполняются в порядке возрастания суммы квантовых чисел (n+l), а при равной сумме (n+l) – в порядке возрастания числа n. Порядок заполнения орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 4f14 5d2-10 6p6 7s2 6d1 5f14 6d2-10 7p6 8s2
Цифры означают энергетические уровени, буквы энергетические подуровни, степени – число электронов на подуровне.
Например:
после 3p-подуровня (n+l=3+1=4; n=3)
заполняется 4s-подуровень (n+l=4+0=4; n=4),
затем 3d-подуровень (n+l=3+2=5; n=3),
4p-подуровень (n+l=4+1=5; n=4) и
5s-подуровень (n+l=5+0=5; n=5).
Схематически АО обозначают клетками, электроны – стрелками. Стрели направлены в одну сторону, если спины одинаковы, в обратные – если спины противоположны.
Дата добавления: 2015-11-10; просмотров: 549;
