Стехиометрические законы
Основные понятия и законы.
Моль, молярная масса, молярный объем, эквивалент
Моль – количество вещества, в котором содержится число Авогадро молекул.
NA=моль-1 (т.е. 6,02·1023 в моле) – число Авогадро.
То есть моль – это порция вещества состоящая из 6,02·1023 штук молекул).
Количество вещества (n) – число молей вещества – используется в химии наряду с массой для характеристики порции вещества (единица измерения: моль). n =N/NA,
где N – число молекул в данной порции вещества.
Моль вещества численно равен молярной массе вещества, выраженной в г.
Молярная масса (М) – масса 1 моля вещества, численно равна молекулярной массе этого вещества (единица измерения: г/моль).
Молекулярная масса (Mr) – сумма относительных атомных масс (указанных в Таблице Менделеева) элементов, образующих молекулу.
Из этого следует, что n = m/М
Молярный объем (VМ) – объем, занимаемый 1 молем вещества (единица измерения л/моль) – важная характеристика газообразных веществ
VМ =М/ρ= V/n ,
где М – молярная масса газа, ρ – плотность газа, V – объем, занимаемый газом, n – количество газа (число молей).
Таким образом, верны соотношения: n =N/NA= m/М= V/VМ
Стехиометрические законы
Закон Авогадро: Равные объемы разных газов содержат при одинаковом давлении и одинаковой температуре равное число молекул.
Поскольку в газах расстояние между молекулами гораздо больше, размера самих молекул, объем газа (V) зависит не от размера молекул и плотности их упаковки, как в жидкостях и твердых веществах, а от внешних условий (температуры и давления).
Следствие из закона Авогадро: при одинаковых условиях равные количества разных газов занимают равные объёмы.
Или: Объем 1 моля (т.е. 6,02·1023 молекул) любого газа при одинаковых условиях есть величина постоянная.
т.е., если n1 = n2, Т1=Т2 Р1=Р2, то V1газа = V2газа
При нормальных условиях (н.у.)
Т=273K=0°С и Р=101,3·105 Па=1 атм,
VМ(н.у.)=22,4 л
Например: 2г водорода (1 моль) и 32г кислорода (1 моль) занимают при одинаковых условиях одинаковый объем, равный при н.у. 22,4 моль/л.
Расчет объема газа по его массе:
Поскольку VM = V/n, то
V = VM · n = VМ·mгаза/Mгаза.
При н.у. Vгаза = 22,4· n = 22,4·mгаза/Mгаза
Закон сохранения массы вещества, Ломоносов, 1748г.
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
3Fe(тв)+2O2(г)=Fe3O4(тв) 3·56 + 2· (2·16) = (3·56+4·16)
Закон постоянства состава веществ, Пруст, 1808г.
Каждое чистое вещество имеет один и тот же состав независимо от его происхождения. СН4+2О2=СО2+2Н2О
Na2CO3+2HCl=2NaCl+H2O+CO2
Закон кратных отношений, Дальтон, 1803г.
Количества реагирующих веществ и продуктов реакции относятся между собой, как небольшие целые числа.
Закон простых объемных отношений, Гей-Люсак, 1808г.
Объемы, вступающих в реакцию газов, относятся друг к другу и к объемам образующихся газообразных соединений, как небольшие целые числа.
Закон эквивалентов:вещества реагируют друг с другом и образуются в результате химической реакции в соотношениях, пропорциональных их эквивалентам: m1Э2=m2Э1
Эквивалент – реальная или условная частица вещества, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в реакциях ионного обмена и электрону в окислительно-восстановительных реакциях.
Эквивалентом (Э) – также называют массу вещества в а. е. м. эквивалентную в реакции атомной массе водорода (1,008) или половине атомной массы кислорода (15,9994/2) (единица измерения а. е. м. или отн. ат. ед. массы).
Эквивалентом вещества – также называют количество вещества, которое соединяется без остатка с 1 молем атомов Н (т. е. с 1 г Н2) или замещает это количество водорода в химической реакции (единица измерения г/моль-экв).
Эквивалентное число (z) – целое число ≥ 1, равно числу эквивалентов вещества в 1 молекуле вещества.
Фактор эквивалентности (f) – число ≤1, показывает, какая часть молекулы соответствует эквиваленту вещества.
Молярная масса эквивалента (Мэкв, эквивалентная масса) – масса 1 моля эквивалентов вещества (единица измерения г/моль или г/моль-экв).
Мэкв=М·f
Мэкв(Na)= 23 г/моль·1=23 г/моль
Мэкв(Al)= 27 г/моль·1/3=9 г/моль.
Молярный объем эквивалента (Vэкв) – это объем, занимаемый 1моль-экв газа.
При нормальных условиях (н.у.) t=0°C, Р=1 атм
Vэкв(Н2)=22,4/2=11,2 л/моль-экв,
Vэкв(О2)=22,4/4=5,6л/моль-экв.
Количество эквивалентов вещества (nэкв) – число молей эквивалентов вещества,
nэкв= 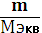 =
= 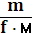 =
= 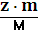 =zn
=zn
Правила расчета Мэкв веществ разных классов:
Эквивалент кислоты – такое её количество, которое содержит 1 моль атомов водорода, способных замещаться катионами металла.
Мэкв к-ты=Мк-ты/основность к-ты, f=1/основность к-ты
Э(HCl)=HCl Мэкв(HCl)=М(HCl)/1=36,5 г/моль/1=36,5 г/моль
Э(H2SO4)=1/2 H2SO4 Мэкв(H2SO4)=М(H2SO4)/2=98 г/моль/2=49 г/моль
Э(CH3COOH)= CH3COOH Мэкв(CH3COOH)=М(CH3COOH)/1=60 г/моль,
Эквивалент основания – такое его количество, которое содержит 1 моль гидроксильных групп, способных замещаться кислотными остатками.
Мэкв осн=Мосн/кислотность основания f=1/кислотность основания
Э(NaOH)= NaOH Мэкв(NaOH)=М(NaOH)/1=40 г/моль/1=40 г/моль
Э(Al(OH)3)=1/3Al(OH)3
Мэкв(Al(OH)3)=М (Al(OH)3)/3=68г/моль/3=22,7г/моль
Эквивалент соли – это такое ее количество, которое приходится на единицу валентности катиона, образующего соль.
Мэкв соли=Мсоли/(валентность металла·индекс)
f=1/валентность металла·индекс
Э(Na+Cl)=1 NaCl Мэкв(NaCl)=М(NaCl)/1·=58,5/1=58,5 г/моль
Э(Na+2SO4)=1/2Na2SO4 Мэкв(Na2SO4)=М(Na2SO4)/(1·2)=142/2=71 г/моль
Э(Ca2+SO4)=1/2 CaSO4 Мэкв(CaSO4)=М(CaSO4)/(2·1)=136/2=68 г/моль
Э(Al3+Cl3)=1/3 AlCl3 Мэкв(AlCl3)=М (AlCl3)/(3·1)=133,5/3=44,5 г/моль
Э(Al3+2(SO4)3)=1/6Al2(SO4)3 Мэкв(Al2(SO4)3)=М(Al2(SO4)3)/(3·2)=342/6=57г/моль
Э(Na3[Cr(OH)6])=1/3/Na3[Cr(OH)6] Мэкв(Na3[Cr(OH)6])=М(Na3[Cr(OH)6])/3=223/3=74,3г/моль
Следует понимать, что участвуя разных реакциях вещество может иметь разные эквиваленты и, соответственно, разные факторы эквивалентности. Эквивалент вещества в реакции может не совпадать с эквивалентом этого вещества, определяемого по правилу.
Пример 1 Определите эквивалент Э, фактор эквивалентности f, число эквивалентности z, молярную массу эквивалента H3РO4 рассматривая ее,
а) как многоосновную кислоту,
б) в реакциях ионного обмена Н3РО4+NaОН→NaН2РО4+Н2О
Н3РО4+2NaОН→ Na 2НРО4+2Н2О
Н3РО4+3NaОН→Na3РО4 +3Н2О
Решение
а) фосфорная кислота трехосновная, Э(H3РO4)=1/3 H3РO4, f=1/3, z=3
Мэкв к-ты=Мк-ты/основность к-ты
М(H3РO4)/3=(3·1+31+4·16)/3=98/3=32,7г/моль
б) Эквивалент в реакциях ионного обмена рассчитываем по числу замещенных катионов Н+ или ОН–.
в реакции Н3РО4+NaОН→NaН2РО4+Н2О
Э(H3РO4)=H3РO4, f=1, z=1,
Мэкв = f·М(H3РO4)= 98г/моль
в реакции Н3РО4+2NaОН→ Na 2НРО4+2Н2О
Э(H3РO4)= 1/2H3РO4, f=1/2, z=2,
Мэкв =f ·М(H3РO4)=1/2·98=49 г/моль
в реакции Н3РО4+3NaОН→Na3РО4 +3Н2О.
Э(H3РO4)= 1/3H3РO4, f=1/3, z=3,
Мэкв =f·М(H3РO4)=1/3·98=32,7 г/моль
Пример 2
Определите эквивалент Э, фактор эквивалентности f, число эквивалентности z, молярную массу эквивалента сульфита калия К2SO3, рассматривая его,
|
|
г) в окисления-восстановления реакции, как восстановитель K2S+4O3 → K2S-2
Решение
а) эквивалент соли рассчитывают на единицу валентности катиона, образующего соль f=1/(валентность металла·индекс) =1/(1· 2)
Э(K2SO3)=1/2 K2SO3, f=1/2, z=2
Мэкв соли=Мсоли/(валентность металла·индекс)
М(K2SO3)/(1·2)=(2·39+32+3·16) )/2=158/2=79
Дата добавления: 2015-11-10; просмотров: 664;
