Тема6 Растворы. Способы выражения концентрации растворов
ПримерНайти массу AlCl3, необходимую для приготовления 2 л раствора этой соли с массовой долей 12%. Плотность раствора ρ=1090 кг/м3 (1090 г/л). Вычислите нормалльность (молярную концентрацию эквивалента), молярность (молярную концентрацию), моляльность и титр раствора.
Решение:
1. Масса раствора m(р-ра) = V ∙ρ, m(р-ра) = 2л∙1090 г/л = 2180 г
2. Массовая доля ω – число граммов растворенного вещества в 100 г раствора
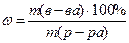
Находим массу AlCl3 для приготовления 2 л раствора с массовой долей 12%.
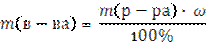
3. По таблице Менделеева находим молярную массу AlCl3 (потребуется для расчета молярной концентрации) и вычисляем молярную массу эквивалента AlCl3 (потребуется для расчета нормальной концентрации).
М(AlCl3) = 27+3∙35,5=133,5 (г/моль) – молярная масса AlCl3,
МЭКВ(AlCl3) = 133,5/3= 44,5 г/моль-экв – молярная масса эквивалента AlCl3.
Как найти эквивалет соли описано в главе 1.
Находим число молей AlCl3 (количество вещества) и число моль-эквивалентов
n(в-ва)=m(в-ва)/М(в-ва)=261,6 / 133,5 = 1,96 (моль)
nэкв(в-ва)=m(в-ва)/Мэкв(в-ва)= 261,6 / 44,5= 5,88 моль-экв
4. Находим молярную концентрацию СМ, т.е. число молей AlCl3 в 1 л раствора.
См = n / V = 1,96 /2 = 0,98 моль/л
5. Находим молярную концентрацию эквивалента (нормальность) СH, т.е. число эквивалентов вещества в 1 л раствора (моль-экв/л), т.е.
| Сн = См для NaCl | Сн = 3См для AlCl3 |
| Сн = 2См для CaCl2, CuSO4 | Сн = 6См для Al2(SO4)3 |
6. Находим моляльность раствора Сm, т.е. число молей растворенного вещества в 1 кг растворителя (моль/кг). Для этого найдем массу воды.
m(воды) = m(р-ра) – m(в-ва) = 2180,0 г – 261,6 г = 1918,4 г=1,92 кг
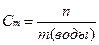 =
= 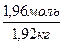 = 1,02 моль/кг.
= 1,02 моль/кг.
7. Находим титр раствора, т.е. массу (г) растворенного вещества, содержащегося в 1 мл раствора.
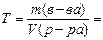
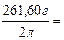
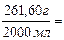 0,1308 г/мл.
0,1308 г/мл.
Дата добавления: 2015-11-10; просмотров: 663;
