Основы графического метода в термодинамике.
5.1. p – v диаграмма.
На рис. 2.8 представлены графики зависимости pv=RуT для различных изопроцессов: показан ход изобары (p = const), изохоры (v = const), изотермы (pv = const), изоэнтропы (pvk = const) для идеального газа. По построению в p – v координатах две линии – прямые (p и v), одна (T = const) – равнобокая гипербола и неравнобокая – изоэнтропа (s = const) pvk = const.
Такой график удобен для качественного анализа изменения параметров и функций процессов. Для точных расчетов не используется.
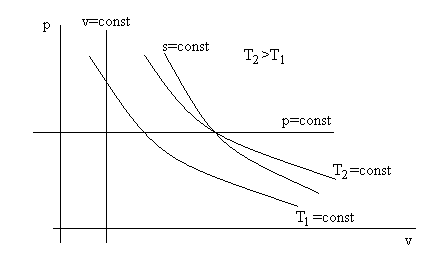
Рис. 2.8 Графики зависимостей р от v для различных изопроцессов p, v, T, s = const с
рабочим телом в состоянии идеального газа.
5.2. T – s диаграмма.
Рассмотрим ход кривых p = const и v = const в диаграмме с координатами T – s. В термодинамике количество термического воздействия (теплоты) рассчитывается как dq = Tds, а в калориметрии – как dq = cdT. Отсюда
Tds = cdT → ds = cdT/T → s2 –s1 = 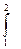 [cx(T)/T] dT =
[cx(T)/T] dT =  ln T2/T1.
ln T2/T1.
Расчетную формулу для приращения энтропии Δs получим из сх|t2t1 при х = р или х =v:
Δs = 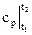 lnT2/T1 для p = const и Δs =
lnT2/T1 для p = const и Δs = 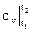 lnT2/T1 для v = const. (2.31)
lnT2/T1 для v = const. (2.31)
Окончательно,
T2 = T1exp{(s –s0)/ 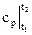 } и T2 = T1exp{(s –s0)/
} и T2 = T1exp{(s –s0)/ 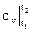 }.
}.
Таким образом, изобара и изохора в осях T – s являются обычными экспонентами, причем из-за того, что ср > cv, изохора круче изобары (см. рис. 2.9), т.к. dT/ds = T/c – тангенс угла касательной к графику соответствующей кривой.
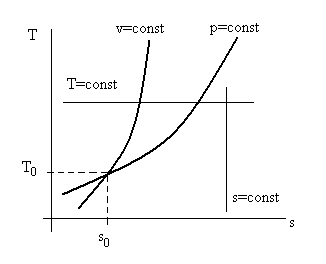
Рис. 2.9. Взаимное расположение графиков процессов
p = const и v = const в осях (Ts), так как cp > cv то изохора проходит круче изобары.
Здесь же показаны процессы s = const и Т = const.
В поле графика T – s (см. рис. 2.9) прямые линии T = const и s = const при избранных масштабах температур и условных значений энтропии (отсчет от s0 = 0 в избранном масштабе), а так же экспоненты p = conct и v = const образуют сетку энтропийной (тепловой) диаграммы.
Возможно использование оси ординат для нанесения условного значения энтальпии от h0 = 0: h = cр|t0*t кДж/кг. Такая диаграмма удобна для широко распространенных изобарных и изоэнтропийных процессов. В первом случае (p = const) dh = Tds + vdp, т.е. h = ∫Tds = qp. Во втором (s = const) dh = Tds + vdp, т.е. h = ∫vdp – работа компрессора.
Для инженерной практики теплофизические институты создают диаграммы p – v и T – s для различных веществ и рабочих тел. Использование их существенно ускоряет расчетный процесс, если не требуется особенная точность.
Дата добавления: 2015-08-21; просмотров: 1850;
