Тип 2: Вычисление по химическим уравнениям масс веществ по известному количеству вещества одного из вступающих или получающихся в реакции веществ.
Если в задаче речь идет о химическом взаимодействии, решение начинают с написания уравнения реакции. Затем над формулами веществ записывают данные задачи. Под формулами, прежде всего, указывают количество веществ в соответствии с коэффициентами и молярные массы веществ.
Расчеты удобнее всего вести по количествам веществ. Часто это упрощает расчеты.
Пример: Найти массу Na2CO3, которая получится при пропускании через избыток NaOH всего углекислого газа, полученного при сжигании углерода, массой 24 г.
| Дано: | |
| m(C) = 24 г | |
| m(Na2CO3) = ? |
Решение:
24 г Х г
C + O2 = CO2, 2NaOH + CO2 ® Na2CO3 + H2O,
1моль 1 моль 1 моль 1 моль
M=12 г/моль M=106 г/моль
n(Na2CO3) = n(CO2), n(CO2) = n(C), отсюда n(Na2CO3) = n(C),
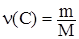 ,
, 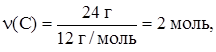 n(Na2CO3) = 2 моль,
n(Na2CO3) = 2 моль,
m(Na2CO3) = 106 г/моль · 2 моль = 212 г.
Если расчеты ведутся по одному уравнению, то можно вести их и по массе. В этом случае рекомендуют подробную запись перехода от количества вещества к массе.
Пример: Найти массу H2O, которая получится при взаимодействии водорода, массой 8 г, с избытком кислорода.
| Дано: | |
| m(H2) = 8 г | |
| m(H2O) = ? |
Решение:
8 г Х г
2H2 + O2 = 2H2O.
2 моль 2 моль
M = 2 г/моль M = 18 г/моль
m = 4 г m = 36 г
4 г H2 - 36 г H2O
8 г H2 - х г H2O,
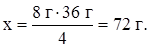
Дата добавления: 2015-08-21; просмотров: 1259;
