Эффект Джоуля-Томсона
Рассмотрим экспериментальную установку, изображенную на рис. 5 (Джоуль и Томсон, 1852-1862). Из сосуда 1, где поддерживается давление p1, газ медленно перетекает через пористую пробку П (вата) в сосуд 2 с давлением p2 (p2 < p1). Система теплоизолирована (приток тепла Q = 0). Считаем, что тепловое равновесие между газом и пробкой установилось.
Стационарное течение газа через пористую пробку при указанных условиях называется течением Джоуля-Томсона.
Будем измерять температуры Т1 и Т2 по обе стороны от пробки. Легко видеть, что некоторая масса газа, занимавшая слева от пробки объем V1, а после протекания занявшая объем V2 справа от нее (см. рис. 5), совершила работу А = p2V2 — p1 V1.
Первое начало термодинамики позволяет нам определить изменение внутренней энергии этой порции газа:
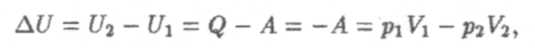
или U1 + p1V1 = U2 + p2V2.Величина I = U + pV носит название энтальпии. To есть, при течении Джоуля-Томсона энтальпия сохраняется.
Для идеального газа p2V2= p1V1(закон Бойля-Мариотта). Значит, А = 0 и ∆U= 0 — при таких условиях внутренняя энергия идеального газа не меняется. А внутренняя энергия идеального газа совпадает с суммарной кинетической энергией всех его молекул Wk, которая зависит только от температуры: Wk = CvT (здесь Сv — молярная теплоемкость газа при постоянном объеме). Поэтому при проведении описанного опыта над идеальным газом температура не должна изменяться: Т1 = Т2. Однако Джоуль и Томсон обнаружили изменение температуры.
Эффект Джоуля-Томсона состоит в изменении температуры газа при течении Джоуля- Томсона.
Большинство газов охлаждались при таком расширении: Т2 < T1 (положительный эффект Джоуля-Томсона). Водород же, напротив, нагревался: Т2 < T1 (отрицательный эффект Джоуля-Томсона). Модель идеального газа не в силах объяснить рассмотренный эффект.
Эффект Джоуля-Томсона применяется, например, в машине Линде для получения жидкого воздуха. Воздуху, сжатому первоначально примерно до 100 атм, дают резко расшириться. Так как знак эффекта Джоуля-Томсона в этом случае положителен, температура снижается, что позволяет охладить новую порцию сжатого воздуха, которому опять дают расшириться, и так далее. На каком-то этапе температура очередной порции становится столь низкой, что воздух ожижается.
В изложенных ранее главах молекулярно-кинетической теории мы имели дело с моделью идеального газа. Идеальный газ состоит из беспорядочно движущихся молекул, причем предполагается, что:
• Можно пренебречь размерами молекул по сравнению с меж молекулярными расстояниями.
• Молекулы не взаимодействуют друг с другом на расстоянии. При непосредственном столкновении молекул они взаимодействуют как абсолютно упругие шары.
Идеальный газ в точности подчиняется экспериментальным законам Бойля-Мариотта, Шарля и Гей-Люссака. Уравнение состояния одного моля идеального газа имеет вид:

— уравнение Менделеева-Клапейрона (здесь Vμ - объем одного моля газа). Однако опыт Эндрюса показал, что для реальных газов соотношение (1) выполняется лишь приближенно, да и то если температура превышает критическую. Модель идеального газа даже качественно не описывает переход из газообразного в жидкое состояние. Таким образом, для более точного описания свойств реального газа следует отказаться от упрощающих положений, сформулированных вначале, введя в уравнение (1) следующие поправки:
• Поправка на наличие собственных размеров молекул.
• Поправка на межмолекулярное взаимодействие не только при непосредственном столкновении, но и но расстоянии. Рассмотрим наиболее простой и естественный путь получения уравнения состояния реального газа (Ван-дер-Ваальс, 1873).
Дата добавления: 2015-08-11; просмотров: 1464;
