Фазовые переходы
Вещество может переходить из одного агрегатного состояния в другое — совершать фазовый переход. Образование газа из жидкости называется испарением, а из твердого тела — возгонкой. Обратные процессы — соответственно, конденсация (или ожижение)и осаждение. При плавлении твердого тела получается жидкость, которая после кристаллизации опять превращается в твердое тело.
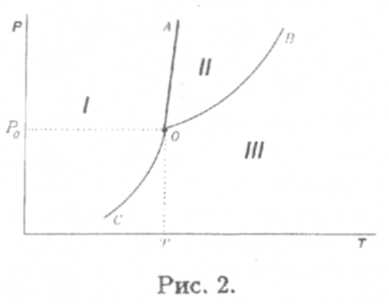
Средняя кинетическая энергия молекул вещества зависит только от его температуры, а потенциальная (при заданной температуре) еще от давления. Поэтому агрегатное состояние вещества полностью определяется его температурой Т и давлением р. При высокой температуре и небольшом давлении имеем газ, с повышением давления и снижением температуры газ конденсируется в жидкость. Дальнейшее падение температуры и повышение давления приводит к кристаллизации и образованию твердой фазы.
На плоскости (р,Т) (см. рис. 2) указаны области, соответствующие твердому I, жидкому II и газообразному IIIсостояниям. Вдоль границ раздела указанных областей— кривых OA, OB и ОС — сосуществуют одновременно по две фазы. Так, при Т < Т0 газ может быть в равновесии только с твердой фазой, при Т > Т0 — только с жидкой. В точке О имеют место одновременно все три фазы, поэтому точка О и называется тройной точкой, а картина на рис. 2 — диаграммой состояний.
Далее в этой главе изучаются свойства веществ в различных агрегатных состояниях и переходы между ними. Частично эти
вопросы затрагивались и ранее: модель идеального газа неплохо описывает свойства газов при высоких температурах и низких давлениях. В связи с выводом уравнения переноса рассматривались явления теплопроводности и диффузии в веществе. Кроме того, в разделе "Механика" рассказано об упругих свойствах твердого тела.
Вообще говоря, параметры вещества (плотность, упругость и пр.) гораздо меньше меняются при переходе жидкость — твердое тело, чем жидкость — газ или твердое тело — газ. Поэтому жидкость по своим свойствам ближе к твердому телу, нежели к газу. Жидкое и твердое состояния часто объединяют одним термином — конденсированное состояние. Исключение составляют гидродинамические явления — здесь у жидкости много общего с газом.
Опыт Эндрюса.
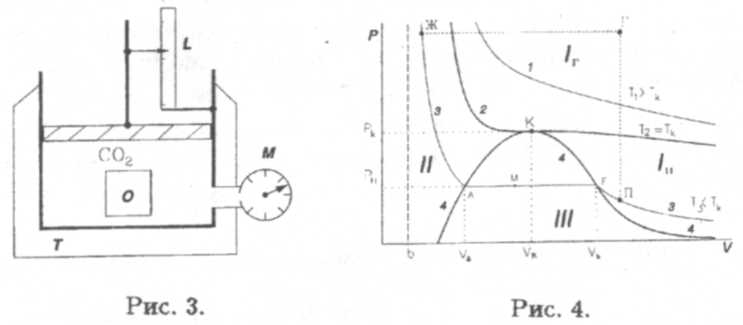
Рассмотрим более подробно фазовый переход между газом и жидкостью (Эндрюс, 1869). Схема экспериментальной установки приведена на рис. 3. Под поршнем в цилиндре находится моль углекислоты С02. Цилиндр помещен в термостат T, который позволяет поддерживать любую нужную температуру Т. Объем вещества V под поршнем определяется по линейке L, а давление р — по манометру М. Визуально наблюдать за происходящим в цилиндре можно через застекленное окошечко О.
При помощи описанной установки были проведены изотермические процессы, некоторые из которых схематически изображены на рис. 4. При достаточно высоких температурах (для
углекислоты Т > 304 К) эти изотермы очень похожи на изотермы идеального газа р = RT/V. Под поршнем при этом не происходило никаких видимых изменений.
Когда температура снижалась до некоторой определенной величины (для углекислоты — 304 К), на изотерме появляется точка перегиба (точка К на кривой 2 ). Такая изотерма называется критической. Касательная к критической изотерме в точке К горизонтальна. Точка К, соответствующая ей температура Тk, давление pk и объем Vk также называются критическими (значения Тk и pk для углекислоты см. в таблице 1).
Если же температура была ниже критической, то на некоторой стадии сжатия под поршнем появлялись капельки жидкости, которая, увеличиваясь в количестве, заполняла в конце концов весь цилиндр. Давление на этой стадии не менялось, поэтому на изотерме появлялось горизональное "плато" ( ∆Е на рис. 4).
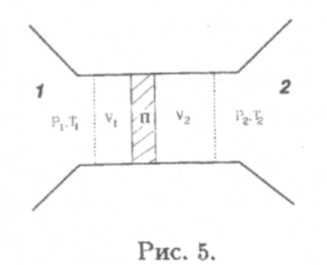
Горизонтальный участок возникает в тот момент, когда газ начинает переходить в жидкость — ожижаться. Произвольная внутренняя точка М отрезка ∆Е соответсвует смеси газа и жидкости. Точка М, таким образом, отвечает двухфазному состоянию вещества. Массы жидкости и газа в точке М относятся как длины отрезков ME и ∆M:
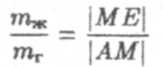
— так называемое правило рычага. Правее точки Е вдоль рассматриваемой изотермы имеется только газ, левее точки А — только жидкость. Заметим, что изотермы, лежащие выше критической, не имеют горизонтальных участков ни при каких давлениях. Поэтому точки этих изотерм соответствуют газообразному состоянию вещества. Теперь становится понятным физический смысл критической температуры:
Газ можно сжатием превратить в жидкость лишь тогда, когда его температура ниже критической. При температурах выше критической ожижение газа невозможно ни при каком давлении.

Таблица 1 содержит критические температуры и давления некоторых распространенных веществ. Из таблицы видно, что
такие газы как азот и кислород (а значит, и их смесь — воздух), а также водород и гелий имеют очень низкую критическую температуру. Поэтому они могут быть ожижены сжатием только
после сильного охлаждения, для чего применяется специальная
криогенная техника.
Для обозначения газа при температуре ниже критической (когда он может быть ожижен) часто используют термин пар. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным. Поэтому давление, при котором происходит ожижение газа ("плато" на рис. 4) называется давлением насы-
щенных паров данного вещества. Оно зависит от температуры.
То что мы называем паром в быту ("пар из чайника", "пар от дыхания") на самом деле — смесь пара, воздуха и мельчайших
капелек воды. Сам водяной пар невидим.
Точки области III на рис. 4 между кривой 4 и прямой р = О
соответствуют двухфазным состояниям вещества, а точки выше этой кривой — однофазным.
Заметим, что газ можно перевести в жидкость и минуя двухфазную область, непрерывно. Пусть начальное состояние газа изображается точкой II на рисунке 4. Нагревая газ при постоянном объеме (изохорически), попадем в точку Г. Затем, сжимая вещество при постоянном давлении (изобарически), получим жидкость (точка Ж на рис. 4). Видно, что процесс, изображаемый ломаной ПГЖ, не содержит двухфазных состояний.
Таким образом, для описания поведения реальных газов при температурах, лишь немного выше критической или ниже ее, модель идеального газа не годится. Необходимо построение новой теории.
Дата добавления: 2015-08-11; просмотров: 2096;
