Аллостерическими эффекторами часто служат различные метаболиты. Конечные продукты - часто ингибиторы,
исходные вещества - активаторы.
Это гетеротропная регуляция, распространённая в биологических системах.
· Более редкий случай: субстрат выступает в качестве положительного эффектора. Такая регуляция называется гомотропной (эффектор и субстрат - одно и то же вещество). Эти ферменты имеют несколько центров связывания для субстрата, которые могут выполнять двойную функцию: каталитическую и регуляторную. Аллостерические ферменты такого типа используются в ситуации, когда субстрат накапливается в избытке и должен быстро преобразоваться в продукт.
· Выявить ферменты с аллостерической регуляцией можно, изучая кинетику этих ферментов. Эти ферменты не подчиняются законам Михаэлиса-Ментен, они имеют характерную S-образную кривую зависимости скорости реакции от концентрации субстрата.
· Особенности строения и функционирования аллостерических ферментов:
o обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение;
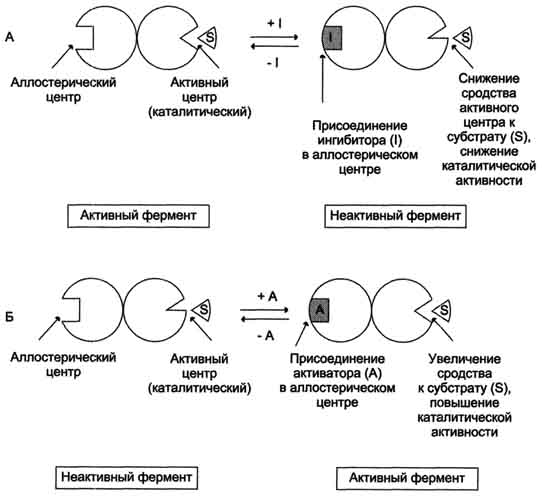
o они имеют аллостерический центр, пространственно удалённый от каталитического активного центра;
o эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах;
oаллостерические центры, так же, как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие - к ингибиторам.
o протомер, на котором находится аллостерический центр, - регуляторный протомер, в отличие от каталитического протомера, содержащего активный центр, в котором проходит химическая реакция;
o аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента;
o регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента;
o аллостерические ферменты катализируют ключевые реакции данного метаболического пути.
Схема работы аллостерического фермента. А - действие отрицательного эффектора (ингибитора); Б - действие положительного эффектора (активатора).
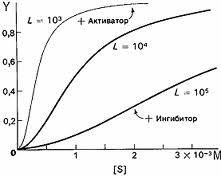
Влияние концентрации субстрата на скорость реакции, катализируемой типичным аллостерическим ферментом.
· Локализация аллостерических ферментов в метаболическом пути.Скорость метаболических процессов зависит от концентрации веществ, использующихся и образующихся в данной цепи реакций. Такая регуляция представляется логичной, так как при накоплении конечного продукта он (конечный продукт) может действовать как аллостерический ингибитор фермента, катализирующего чаще всего начальный этап данного метаболического пути:
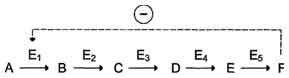
· Фермент, катализирующий превращение субстрата А в продукт В, имеет аллостерический центр для отрицательного эффектора, которым служит конечный продукт метаболического пути F. Если концентрация F увеличивается (т.е. вещество F синтезируется быстрее, чем расходуется), ингибируется активность одного из начальных ферментов. Такую регуляцию называют отрицательной обратной связью, или ретро-ингибированием. Отрицательная обратная связь - часто встречающийся механизм регуляции метаболизма в клетке.
· В центральных метаболических путях исходные вещества могут быть активаторами ключевых ферментов метаболического пути. Как правило, при этом аллостерической активации подвергаются ферменты, катализирующие ключевые реакции заключительных этапов метаболического пути:
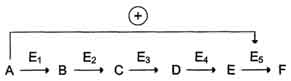
· В качестве примера можно рассмотреть принципы регуляции гликолиза - специфического (начального) пути распада глюкозы. Один из конечных продуктов распада глюкозы - молекула АТФ. При избытке в клетке АТФ происходит ретро-ингибирование аллостерических ферментов фосфофруктокиназы и пируваткиназы. При образовании большого количества фруктозо-1,6-бисфосфата наблюдают аллостерическую активацию фермента пируваткиназы.
- Благодаря такой регуляции осуществляется слаженность протекания метаболического пути распада глюкозы.
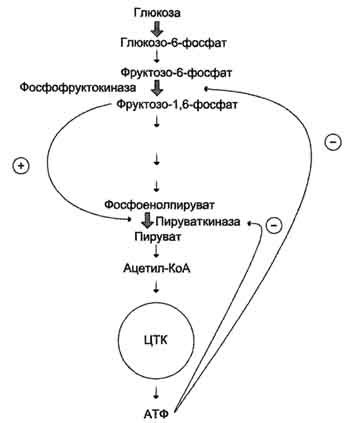
Схема положительной и отрицательной регуляции катаболизма глюкозы. Молекула АТФ участвует в ингибировании (ретроингибировании) аллостерических ферментов фосфофруктокиназы и пируваткиназы. Фруктоза-1,6-бисфосфат - активатор метаболического пути распада глюкозы. Плюсами отмечена активация, минусами - ингибирование ферментов.
Дата добавления: 2015-07-24; просмотров: 2634;
