Теплоемкость газа. Теплоемкостью тела СТ называют отношение количества теплоты Q, сообщенного телу, к изменению температуры ∆T
Теплоемкостью тела СТ называют отношение количества теплоты Q, сообщенного телу, к изменению температуры ∆T, вызванному этой теплопередачей.

Различают удельную теплоемкость вещества (с) и молярную теплоемкость (С).
Удельной теплоемкостью вещества называют количество теплоты, необходимое для нагревания 1 кг вещества на 1 К

Молярной теплоемкостью называют количество теплоты, необходимое для нагревания 1 моля вещества на 1К.
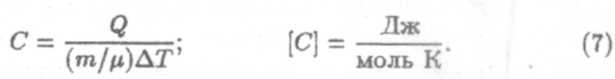
Между удельной и молярной теплоемкостями существует очевидная связь

Далее для простоты все рассуждения и формулы будут связаны с молярной теплоемкостью.
Оказывается, что теплоемкость существенно зависит от того, при каких условиях нагревается газ. Различают теплоемкость при постоянном объеме Сvи теплоемкость при постоянном давлении Ср. При постоянной температуре теплоемкость равна бесконечности, так как ∆T= 0.
Рассмотрим 1 моль газа, нагреваемый при постоянном объеме (V = const, v = т/μ = 1 моль). На основании первого начала термодинамики все поступающее газу тепло идет на изменение его внутренней энергии Q = ∆U.
Получим выражение для теплоемкости газа при постоянном объеме.
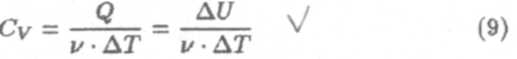
Учитывая, что ∆U = (i/2)v/R∆T, получим:

Таким образом, молярная теплоемкость при постоянном объеме зависит только от числа степеней свободы i молекулы газа, т.е. от количества атомов в молекуле и от ее структуры.
Теперь пусть 1 моль газа нагревается при постоянном давлении (р = const, v = 1 моль). В этом случае поступающее газу тепло идет, в соответствии с первым началом термодинамики, не только на изменение его внутренней энергии, но и на работу расширения газа (именно расширение газа обеспечивает постоянство давления). А это означает, что теплоемкость газа при постоянном давлении больше его теплоемкости при постоянном объеме (Ср > Сv). Чтобы найти их разницу, вычислим предварительно работу расширения 1 моля газа при изобарном процессе. В соответствии с формулой (3), эта работа А = р∆V = р(V2 – V1) = pV3 – pV1. Учтем уравнение Менделеева-Клапейрона, тогда
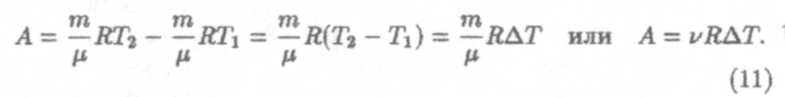
Формула (11) позволяет установить физический смысл универсальной газовой постоянной R. По условию р = const и v = 1 моль; положим, что ∆Т = 1К, тогда численно А = R или универсальная газовая постоянная численно равна работе расширения одного моля идеального газа при нагревании его на 1К при постоянном давлении.
Чтобы найти формулу теплоемкости газа при постоянном давлении, воспользуемся определением молярной теплоемкости (7) и первым началом термодинамики
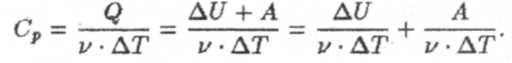
Учитывая в первом слагаемом формулу (9), а во втором (11), получим

Это выражение называется уравнением Майера.Подставим в это уравнение выражение (10), получим
Важной термодинамической характеристикой является отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме τ
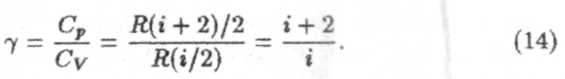
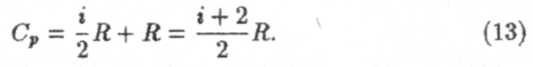
Из формул (10) и (13) следует, что по значениям теплоемкостей все газы можно подразделить на три сорта: одноатомные, двухатомные и многоатомные газы. Поэтому легко подсчитать все возможные значения их теплоемкостей. Все результаты и выводы из данного параграфа можно отнести к классической теории теплоемкостей. Непосредственные измерения показали, что справедлива эта теория в полном объеме только для одноатомных газов. Двух- и многоатомные газы дают существенные отличия экспериментальных значений теплоемкости от теоретических, особенно при температурах, существенно отличающихся от нормальной. Наиболее полно и правильно этот вопрос рассматривает квантовая теория теплоемкости. Выражения для теплоемкости твердых тел можно найти в лекции №17.
Дата добавления: 2015-08-11; просмотров: 1399;
