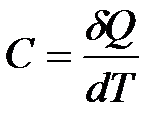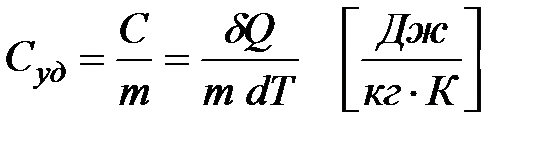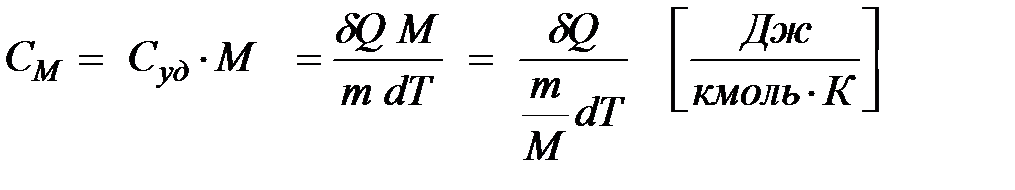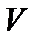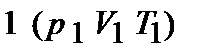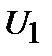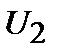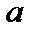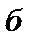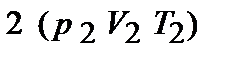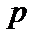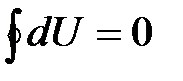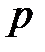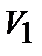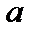Основные термодинамические понятия: энергия, работа, теплота, теплоемкость, термодинамические функции состояния.
Термодинамика – это учение о связи и взаимных превращениях различных форм энергии, теплоты и работы. Термодинамика строится на основе фундаментальных принципов (законов, начал), которые являются обобщением многочисленных наблюдений и результатов эксперимента. С помощью этих законов, не вникая в молекулярное строение тел, можно получить многие сведения о свойствах тел в различных условиях.
Совокупность рассматриваемых тел, обменивающихся энергией между собой и с другими (внешними) телами, называется термодинамической системой.Термодинамической системой может быть совокупность большого числа микрочастиц, участвующих в тепловом движении; может быть тело, часть тела или совокупность тел.
При изучении термодинамической системы необходимо учитывать не только механическую энергию (кинематическую и потенциальную) системы как целого, но и энергию движения и взаимодействия микрочастиц этой системы, называемую внутренней энергией системы. В общем случае внутренняя энергия системы складывается из кинетической энергии теплового движения молекул, потенциальной энергии их взаимодействия, внутриатомной и внутриядерной энергий. Два последних вида энергии термодинамика не учитывает. В идеальном газе, кроме того, пренебрегают потенциальной энергией взаимодействия молекул. Внутренняя энергия определяется состоянием тела. Это значит, что, если термодинамическая система находится в состоянии 1, характеризуемом параметрами 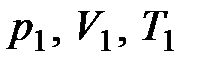 (рис. 1.1), то внутренняя энергия в этом состоянии может иметь единственное значение энергии, определяемой формулой:
(рис. 1.1), то внутренняя энергия в этом состоянии может иметь единственное значение энергии, определяемой формулой:
При переводе системы в другое состояние с параметрами 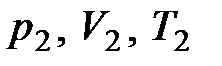 состояние системы будет уже другим и внутренняя энергия примет значение
состояние системы будет уже другим и внутренняя энергия примет значение
Следовательно, внутренняя энергия является функцией состояния системы.
|
| Если в результате какого-то процесса система возвращается в первоначальное состояние (рис. 1.2), то изменение ее внутренней энергии будет равно нулю, т.е.
Переход системы путем расширения или сжатия из одного состояния в другое сопровождается совершением работы. При этом происходит изменение состояния системы, изменяется ее энергия.
|
Работа – это мера переданной механической энергии системы в процессе перехода ее из одного состояния в другое.
На рис. 1.1 изображен процесс расширения газа (кривая  ). Если бы условия расширения были другими, и кривая расширения была бы другой (например,
). Если бы условия расширения были другими, и кривая расширения была бы другой (например,  ).
).
Полная работа расширения при переходе системы из состояния 1 в состояние 2 равна:
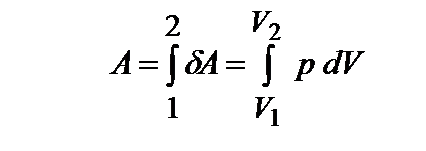
| (1.2)
|
Предположим, что газ вначале расширяется (линия 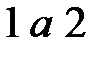 ) на рис.1.6, а затем сжимается (линия
) на рис.1.6, а затем сжимается (линия 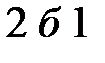 ) и возвращается в первоначальное состояние. При расширении
) и возвращается в первоначальное состояние. При расширении 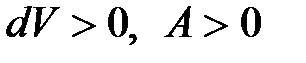 - газ совершает работу, численно равную площади фигуры
- газ совершает работу, численно равную площади фигуры 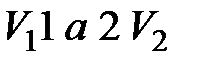 .
.
При сжатии газа 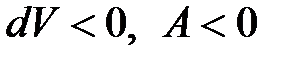 - работу совершают внешние силы. Эта работа численно равна площади фигуры
- работу совершают внешние силы. Эта работа численно равна площади фигуры  . Работа, совершаемая в рассмотренном замкнутом процессе (цикле), численно равна площади фигуры, ограниченной графиком замкнутого процесса.
. Работа, совершаемая в рассмотренном замкнутом процессе (цикле), численно равна площади фигуры, ограниченной графиком замкнутого процесса.
|
| Существует и другой способ передачи энергии, при котором происходит изменение энергии хаотического молекулярного движения взаимодействующих систем. Например, при погружении холодного тела в горячую воду уменьшается интенсивность теплового движения молекул воды и увеличивается энергия теплового движения молекул тела, в результате которого температура тел выравнивается.
|
Величину переданной энергии теплового движения молекул измеряют количеством теплоты.
Теплота есть мера переданной в процессе теплопередачи от одного тела к другому энергии теплового (неупорядоченного) движения молекул. В рассмотренном примере тело, погруженное в воду, получает энергию ( 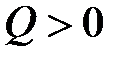 ), а вода отдает (
), а вода отдает ( 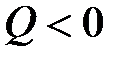 ).
).
Таким образом, теплота и работа – это две эквивалентные, но не равнозначные формы передачи энергии одним телом другому при их взаимодействии. Теплота преобразуется в работу или работа в теплоту в строго количественных соотношениях.
В системе СИ теплота и работа измеряются в одних и тех же единицах – джоулях. Теплота, как и работа, не является функцией состояния системы.
Теплоемкостью  называется физическая величина, численно равная количеству теплоты, которое нужно сообщить телу, чтобы увеличить его температуру на 1 Кельвин.
называется физическая величина, численно равная количеству теплоты, которое нужно сообщить телу, чтобы увеличить его температуру на 1 Кельвин.
Теплоемкость единицы массы вещества называется удельной теплоемкостью
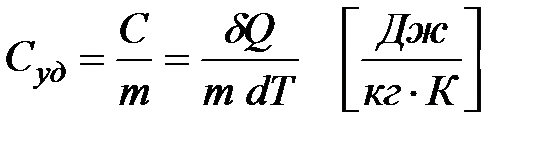
| (1.3)
|
Теплоемкость одного моля (киломоля) вещества называется молярной теплоемкостью
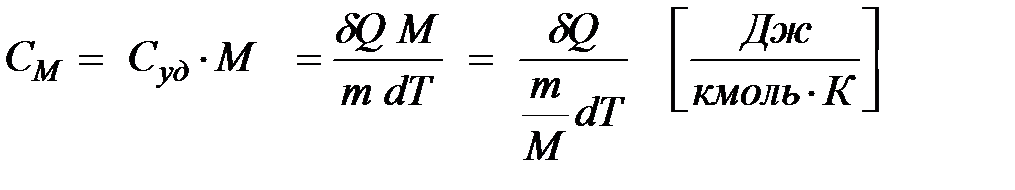
| (1.4)
|
Дата добавления: 2015-08-11; просмотров: 5349;
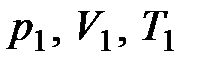 (рис. 1.1), то внутренняя энергия в этом состоянии может иметь единственное значение энергии, определяемой формулой:
(рис. 1.1), то внутренняя энергия в этом состоянии может иметь единственное значение энергии, определяемой формулой: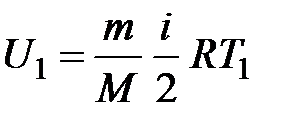
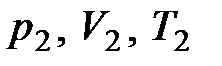 состояние системы будет уже другим и внутренняя энергия примет значение
состояние системы будет уже другим и внутренняя энергия примет значение
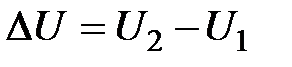 . В состоянии 2 систему можно было перевести через различные промежуточные состояния, например, через состояние
. В состоянии 2 систему можно было перевести через различные промежуточные состояния, например, через состояние  или через состояние
или через состояние  . Измерение внутренней энергии не будет зависеть от пути перехода:
. Измерение внутренней энергии не будет зависеть от пути перехода:
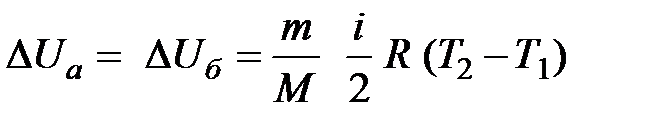
 ). Если бы условия расширения были другими, и кривая расширения была бы другой (например,
). Если бы условия расширения были другими, и кривая расширения была бы другой (например,  ).
).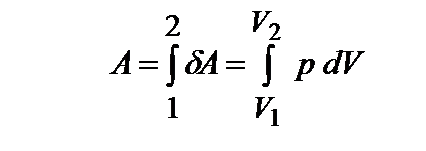
 ) на рис.1.6, а затем сжимается (линия
) на рис.1.6, а затем сжимается (линия 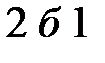 ) и возвращается в первоначальное состояние. При расширении
) и возвращается в первоначальное состояние. При расширении 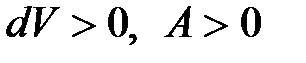 - газ совершает работу, численно равную площади фигуры
- газ совершает работу, численно равную площади фигуры 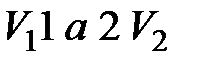 .
.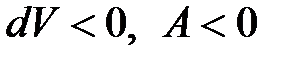 - работу совершают внешние силы. Эта работа численно равна площади фигуры
- работу совершают внешние силы. Эта работа численно равна площади фигуры  . Работа, совершаемая в рассмотренном замкнутом процессе (цикле), численно равна площади фигуры, ограниченной графиком замкнутого процесса.
. Работа, совершаемая в рассмотренном замкнутом процессе (цикле), численно равна площади фигуры, ограниченной графиком замкнутого процесса.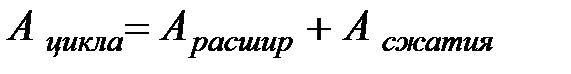
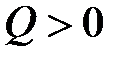 ), а вода отдает (
), а вода отдает ( 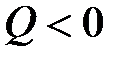 ).
). называется физическая величина, численно равная количеству теплоты, которое нужно сообщить телу, чтобы увеличить его температуру на 1 Кельвин.
называется физическая величина, численно равная количеству теплоты, которое нужно сообщить телу, чтобы увеличить его температуру на 1 Кельвин.