Тема: Растворы. Растворы электролитов
Общие свойства растворов электролитов
Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами. Свойства электролитов были рассмотрены и обобщены в трудах Аррениуса, развиты в трудах И.А. Каблукова, В.А. Кистяковского, на основе гидратной теории растворения Д.И. Менделеева. Основные положения теории электролитической диссоциации (ионизации):
1. При растворении солей, кислот и оснований в воде происходит диссоциация (ионизация) этих соединений с образованием электрически заряженных частиц -катионов и анионов.
2. Электрическая проводимость растворов солей, кислот и оснований в воде прямо пропорциональна общей концентрации ионов в растворе.
Уравнение электролитической диссоциации можно записать, опустив промежуточные стадии, указав лишь начальные и конечные продукты реакции:
АВ+(n+m)Н2О ↔ АР+nН2О + Вq–mН2О (1)
Коэффициенты n и m меняются с изменением концентрации, температуры и других параметров раствора. Поэтому молекулы растворителя обычно опускают и записывают: АВ ↔Ap+ + Вq–.
Растворами электролитов являются растворы щелочей, солей и неорганических кислот в воде и других полярных растворителях (жидком аммиаке, ацетонитриле и др.). Растворы электролитов являются ионными проводниками (проводниками второго рода).
В растворах электролитов наблюдаются отклонения от законов Вант-Гоффа и Рауля. По закону Рауля при растворении 0,1 моль неэлектролита (глюкозы) в 1000 г воды температура замерзания снижается на 0,186 К. Поэтому Вант-Гофф ввел в уравнение p=СRТ поправочный коэффициент i, который назван изотоническим коэффициентом. Для любых разбавленных растворов Росм=iСRТ. Изотонический коэффициент характеризует отклонение от законов идеальных растворов вследствие электролитической диссоциации.
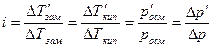
Здесь 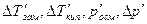 – изменения температур замерзания и кипения, осмотического давления и понижения давления пара для электролита к аналогичному свойству раствора неэлектролита той же концентрации (
– изменения температур замерзания и кипения, осмотического давления и понижения давления пара для электролита к аналогичному свойству раствора неэлектролита той же концентрации ( 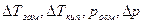 ). Для раствора электролита всегда i>1, для раствора неэлектролита i=1.
). Для раствора электролита всегда i>1, для раствора неэлектролита i=1.
Степень диссоциации электролитов.
Отношение числа молекул, диссоциированных на ионы, к общему числу молекул растворенного электролита называется степенью диссоциации (ионизации) ά: ά = n/nо, где n - число частиц, подвергшихся диссоциации, nо - общее число растворенных частиц. По степени диссоциации электролиты делятся на слабые (ά <3%) и сильные (ά >30%). Степень диссоциации зависит от природы (полярности) растворителя. Чем более полярна молекула растворителя, тем при прочих равных условиях выше степень ионизации растворенного вещества. Поскольку электролитическая диссоциация сопровождается тепловым эффектом, то ά зависит от температуры, причем ее влияние можно оценить по принципу Ле-Шателье: если диссоциация представляет собой эндотермический процесс, то с повышением температуры степень диссоциации растет, с понижением температуры уменьшается.
Сильно влияет на степень электролитической диссоциации концентрация раствора. Если рассматривать диссоциацию как равновесный обратимый химический процесс, то в соответствии с принципом смещения равновесия разбавление водой увеличивает количество диссоциированных молекул, то есть степень диссоциации с разбавлением растет.
Константа диссоциации
Процесс электролитической диссоциации удобнее характеризовать константой диссоциации, применив к нему законы химического равновесия. Так, для реакции КА↔К++А– константа диссоциации 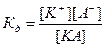 . Здесь и далее в квадратных скобках обозначаются молярные концентрации компонентов. Чем больше
. Здесь и далее в квадратных скобках обозначаются молярные концентрации компонентов. Чем больше
величина 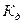 , тем сильнее электролит. Константа диссоциации зависит от природы диссоциирующего вещества и растворителя, а также от температуры, и не зависит от концентрации раствора. Между константой и степенью диссоциации существует количественная зависимость. Пусть в рассмотренном выше процессе диссоциации общее количество растворенного вещества КА равно С, а степень диссоциации ά. Тогда [К+]=[А-]= άС, и, соответственно, концентрация недиссоциированных частиц [КА]= (1- ά)С. Подставив это значение в выражение для константы диссоциации, получим:
, тем сильнее электролит. Константа диссоциации зависит от природы диссоциирующего вещества и растворителя, а также от температуры, и не зависит от концентрации раствора. Между константой и степенью диссоциации существует количественная зависимость. Пусть в рассмотренном выше процессе диссоциации общее количество растворенного вещества КА равно С, а степень диссоциации ά. Тогда [К+]=[А-]= άС, и, соответственно, концентрация недиссоциированных частиц [КА]= (1- ά)С. Подставив это значение в выражение для константы диссоциации, получим:
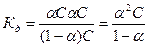 .
.
Это соотношение называется законом разбавления Оствальда. Для слабых электролитов, когда ά много меньше 1, 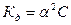 . Отсюда
. Отсюда
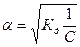 , где V=1/С - разбавление.
, где V=1/С - разбавление.
Из уравнения Оствальда следует, что ά уменьшается с увеличением концентрации слабого электролита. Например, при разбавлении раствора в 1 00 раз степень диссоциации возрастает в 10 раз.
В растворах слабых электролитов взаимодействие ионов друг с другом относительно невелико, вследствие их незначительной концентрации. Сильные электролиты в растворах диссоциированы практически полностью, поэтому концентрация их ионов велика и свойства таких растворов зависят от степени взаимодействия образующихся ионов друг с другом и с полярными молекулами растворителя. За счет этого взаимодействия создается впечатление, что диссоциация прошла и в растворе имеется некоторое количество недиссоциированных молекул. Поэтому ά, определяемая в растворах сильных электролитов экспериментально, является кажущейся и ее значение менее 100%. Поэтому для растворов сильных электролитов не применимы законы идеальных растворов. Чтобы эти законы использовать для описания реальных растворов, Льюис ввел представление об эффективной концентрации - активности а: а=γС, где С - концентрация, γ - коэффициент активности (величина безразмерная). Активность и концентрация измеряются в одних и тех же единицах. Коэффициент активности характеризует степень отклонения свойств данного раствора от свойств идеального. Для бесконечно разбавленных растворов электролитов, где практически отсутствует взаимодействие ионов, а=С и γ=1. Если вместо С в уравнения Вант-Гоффа, Рауля, Оствальда подставлять экспериментальные значения а, то уравнения остаются справедливыми и для сильных электролитов, и вообще для любых реальных растворов.
Вода служит не только наиболее распространенным растворителем, но и сама является идеальным амфолитом. Процесс диссоциации воды называется самоионизацией или автопротолизом, и может быть записан: Н2О+Н2О↔Н3О++ОН–. Часто этот процесс записывают в более простом виде: Н2О↔Н++ОН–. Константа диссоциации этого процесса 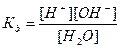 , более строго через активности ионов:
, более строго через активности ионов: 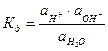 .
.
Так как вода - слабый электролит, можно использовать данные выражения с учетом того, что концентрация воды постоянна: [Н2О]=55,56 моль/л. Тогда [Н+][ОН-]=55,56 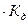 =КW=10-14 – ионное произведение воды. Так как при диссоциации воды [Н+]=[ОН-]=
=КW=10-14 – ионное произведение воды. Так как при диссоциации воды [Н+]=[ОН-]= 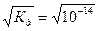 =10-7 моль/л.
=10-7 моль/л.
Ионы водорода являются носителями кислотных свойств, гидроксил-анионы - щелочных. Поэтому при равенстве этих ионов раствор будет нейтральным. Для характеристики кислотности (щелочности) среды введен водородный показатель рН=-lg[Н+]. При рН=7 среда нейтральная, для кислых растворов рН меньше 7, для щелочных рН больше 7.
Аналогичным образом реакция среды может быть охарактеризована гидроксильным показателем рОН=-lg[ОН–]. Для воды рН=рОН=7, рН+рОН=14.
Рассмотрим обменную реакцию КС1+АgNОз=АgС1+КNО3. Равновесие в такой реакции смещено вправо, так как хлорид серебра - малорастворимое соединение. Для насыщенного раствора АgС1, находящегося в равновесии с твердой фазой (осадком), будет характерен следующий процесс: АgCl↔Аg++С1–. Константа равновесия этого гетерогенного процесса Кр=Пр= [Аg+][С1–]. Она не зависит от концентрации твердой фазы (АgС1), является постоянной величиной при данной температуре. Эту величину называют произведением растворимости Пр. Более строго в Пр используют не концентрации, а активности ионов электролита Пр= 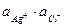 . Применение понятия о Пр аналогично использованию КW. КW определяет ионное равновесие для малодиссоциированного слабого электролита, а произведение растворимости описывает описывает аналогичный процесс для сильного, но малорастворимого соединения.
. Применение понятия о Пр аналогично использованию КW. КW определяет ионное равновесие для малодиссоциированного слабого электролита, а произведение растворимости описывает описывает аналогичный процесс для сильного, но малорастворимого соединения.
Тема: ИОННЫЕ РЕАКЦИИ. ГИДРОЛИЗ
Дата добавления: 2015-08-08; просмотров: 2455;
