Тема: Химическая кинетика и равновесие
Общие представления о скорости химической реакции
Химическая кинетика - это учение о скорости химических реакций, основная ее задача - управление химическими процессами с целью обеспечения большей скорости реакции и максимального выхода продукта.
Одним из основных понятий в химической кинетике является скорость реакции. Скоростью химической реакции ύ называют изменение количества реагирующего вещества за единицу времени в единице реакционного пространства.
Реакции могут протекать с различными скоростями. Одни из них проходят почти мгновенно, другие - очень медленно. Скорость реакции определяется прежде всего природой реагирующих веществ. Но реакция, имеющая практически нулевую скорость при комнатной температуре, может протекать быстро при нагревании. Можно ускорить взаимодействие и при помощи катализатора. Скорость химической реакции зависит от условий протекания процесса. Итак, скорость гомогенной химической реакции измеряется изменением концентрации одного из веществ, участвующих в процессе, за единицу времени, концентрация С выражается обычно в моль/л, а время t - в минутах или секундах; поэтому размерность скорости реакции моль/л·мин или моль/л·с.
Изменение концентрации исходных веществ и продуктов реакции во времени представлена графиком:

 C
C
 2
2
 |
t
Здесь 1 - изменение концентрации исходного вещества, 2 -изменение концентрации продукта реакции.
При химической реакции концентрации исходных веществ уменьшаются во времени, а продуктов реакции - возрастает. Если измеряется скорость образования продуктов реакции, то скорость реакции положительна; если измеряется скорость расходования исходных веществ -скорость реакции отрицательна.
Необходимым условием осуществления химического взаимодействия между двумя молекулами должно их столкновение. Столкновение молекул в некотором реакционном пространстве при заданной температуре происходит тем чаще, чем больше этих молекул. Поэтому скорость химической реакции зависит от концентрации реагирующих веществ. По мере уменьшения концентрации исходных веществ во времени скорость реакции падает.
Зависимость скорости химической реакции от температуры.
Скорость химической реакции зависит от температуры, причем при повышении температуры скорость реакции увеличивается. Голландский ученый Вант-Гофф установил, что при повышении температуры на 10° скорость большинства реакций увеличивается в 2-4 раза: 
Здесь vT2 и vT1 - скорости реакций при температурах Т2 и Т1, γ -температурный коэффициент скорости реакции. Из уравнения следует, что температурный коэффициент скорости реакции равен соотношению температур, когда Т2-Т1= 10°. Величина γ показывает, во сколько раз увеличится скорость реакции при повышении температуры на 10°. При концентрации реагирующих веществ 1 моль/л скорость реакции численно равна константе скорости, тогда
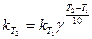 .
.
Константа скорости зависит от температуры так же, как и скорость.
Химическое равновесие. Константа химического равновесия.
Реакции, которые при заданных условиях протекают одновременно в двух взаимопротивоположных направлениях, называются обратимыми и обозначаются mА+nВ↔рС+dD. Согласно закону действия масс, скорости прямой и обратной реакций соответственно равны: ύ1 =k1 [A]m[B]n, ύ2 =k2 [C]p[D]d
При достижении равновесия скорость прямого процесса становится равной скорости обратного: ύ= ύ2. Следовательно, k1 [A]m[B]n = k2 [C]p[D]d , обозначив Kp=k1/k2, получим:
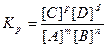 , где Кр - константа равновесия.
, где Кр - константа равновесия.
Значение величины Кр дает возможность судить о преимуществе того или иного процесса. Для гетерогенных реакций в выражение для константы равновесия входят концентрации только тех веществ, которые находятся только в газовой или жидкой фазах. Например, для реакции СО2(г)+С(тв)↔2СО(г) КР=[СО]2/[СО]. Константа равновесия зависит только от температуры и природы реагентов.
Изменение энергии Гиббса ΔG обратимого процесса связано с константой химического равновесия следующим уравнением: ΔG = –RТ1nКр. Здесь R - универсальная газовая постоянная, Т- абсолютная температура.
Эта зависимость позволяет, зная ΔG, вычислить константу равновесия и равновесные концентрации реагирующих веществ. Переходя к десятичному логарифму и подставляя значение R, уравнение принимает вид ΔG =-5,71lgКР, кДж/моль.
В условиях химического равновесия концентрации (или парциальные давления в случае газов) исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями (или парциальными давлениями). Они обозначаются так же, но с индексом р: [СО2]Р, [СО]Р.
Принцип Ле-Шателье.
Химическое равновесие, отвечающее равенству скоростей прямой и обратной реакций, и минимальному значению энергии Гиббса, является наиболее устойчивым состоянием системы при заданных условиях, и остается неизменным до тех пор, пока сохраняются постоянными параметры, при которых равновесие установилось. При изменении условий равновесие нарушается и смещается в ту или иную сторону. Направленные смещения равновесия определяются принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Смещение равновесия может быть вызвано изменением температуры, давления, концентрации одного (или нескольких) реагента.
При повышении температуры увеличивается константа равновесия эндотермического процесса (ΔН>0). Это значит, что при повышении температуры равновесие смещается вправо, в сторону прямой реакции, идущей с поглощением теплоты. Константа равновесия экзотермического процесса (ΔН<0) при повышении температуры уменьшается. Это значит, что при повышении температуры равновесие экзотермической реакции смещается влево.
Смещение равновесия может быть вызвано изменением концентрации одного из компонентов: добавлением вещества в равновесную систему или выводом его из системы. Согласно принципу Ле-Шателье, при увеличении концентрации одного из исходных веществ равновесие смещается в правую сторону, а при увеличении концентрации одного из продуктов реакции - в левую.
Если в обратимой реакции участвует хотя бы одно газообразное вещество, смещение равновесие может быть вызвано изменением давления. Повышение давления при постоянной температуре равносильно сжатию газа, то есть увеличению его концентрации. При увеличении концентрации газообразного компонента скорость реакции в соответствии с законом действия масс возрастает, что приводит к смещению равновесия в направлении уменьшения концентрации газообразного компонента. При понижении давления при постоянной температуре газ расширяется, и его концентрация в системе падает. Это вызывает уменьшение скорости реакции, равновесие смещается в направлении увеличения давления газа. Например, при увеличении давления в системе СаСОз ↔ СаО+СO2 возрастает скорость обратной реакции ύ = k2[СО2], что приводит к смещению равновесия в левую сторону. При понижении давления на ту же систему скорость обратной реакции уменьшается, это приводит к смещению равновесия в правую сторону. В системе 2НС1↔Н2+Cl2 все вещества газообразные, при изменении давления смещения не произойдет, так как обе скорости возрастут одинаково.
Итак, в соответствии с принципом Ле-Шателье при повышении давления равновесие смещается в сторону образования меньшего числа молей газообразных веществ и соответственно в сторону уменьшения давления в системе. Наоборот, при внешнем воздействии, вызывающим понижение давления, равновесие смещается в сторону образования большего числа молей газа, что противодействует внешнему воздействию и вызывает увеличение давления в системе.
Дата добавления: 2015-08-08; просмотров: 1026;
