Реакции нуклеофильного присоединения (АN) к карбонильным соединениям. Окисление и восстановление органических соединений
Карбонильные соединения являются производными углеводородов, в молекулах которых два атома водорода, находившиеся при одном атоме углерода, замещены атомом кислорода. Получающаяся таким путем группа >С=О называется карбонильной группой, или оксогруппой. Если карбонильная группа связана с одним водородным атомом и углеводородным радикалом (или с двумя атомами водорода), то такие соединения называют альдегидами, а группу – альдегидной, если карбонильная группа связана с двумя углеводородными радикалами, соединения называют кетонами, а группу – кетогруппой. Таким образом, альдегиды и кетоны представляют собой один класс органических веществ – оксосоединения.
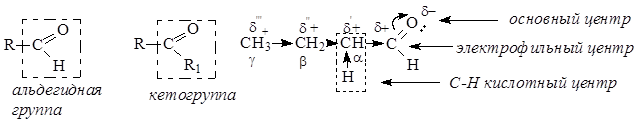
Атомные орбитали углерода карбонильной группы находятся в состоянии sp2-гибридизации. Три гибридные орбитали, расположенные в одной плоскости под углом » 120° друг по отношению к другу, участвуют в образовании трех s-связей. Негибридная р-орбиталь атома углерода, расположенная перпендикулярно плоскости, в которой лежат s-связи, участвует в образовании p-связи с атомом кислорода. Двойная связь углерод-кислород полярная, электронная плотность смещена к более электроотрицательному атому кислорода, на котором возникает частичный отрицательный заряд, а на атоме углерода карбонильной группы – частичный положительный заряд:
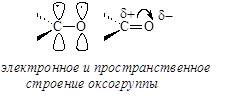
Из этого следует, что характерной для карбонильной группы реакцией должна быть нуклеофильная атака по атому углерода. В молекулах карбонильных соединений, кроме электрофильного центра – атома углерода оксогруппы – есть и другие реакционные центры. Атом кислорода за счет неподеленной пары электронов выступает в реакциях как основный центр, реагируя с кислотами. Альдегиды и кетоны являются слабыми основаниями, концентрация протонированной формы карбонильного соединения достигает величин » 0,1-1% только в 60–80% серной кислоте.
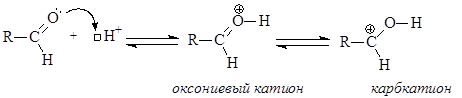
В результате присоединения протона за счет образования s-связи О-Н возрастает электрофильность атома углерода оксогруппы и облегчается присоединение нуклеофильной частицы.
Карбонильные соединения, имеющие атомы водорода в a-положении к оксогруппе, являются слабыми С-Н кислотами и способны под действием сильных оснований образовывать карбанион и енол:

Содержание енола в равновесной смеси составляет » 10-2–10-6 %, однако этого количества достаточно, чтобы протекали реакции с участием енольной формы. В водных растворах в присутствии сильных оснований (рН>12) концентрация аниона может достигать порядка 10-1-10-5% от неионизированного соединения. В спиртовых растворах алкоголятов концентрация образующегося аниона выше и составляет примерно 1-10%.
Поскольку положительный заряд на атоме углерода карбонильной группы обуславливает участие оксосоединений в реакциях АN, то введение в углеводородный радикал электронодонорных заместителей, уменьшающих величину этого заряда, приводит к снижению реакционной способности соединений. Увеличение размеров углеводородных радикалов, связанных с углеродом карбонильной группы, затрудняет нуклеофильную атаку за счет создания стерических препятствий.
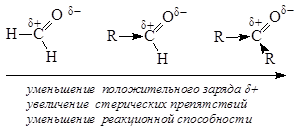
Механизм нуклеофильного присоединения АN:

Реакция протекает через переходное состояние (при написании механизмов реакций АN его обычно опускают), в котором синхронно идет образование s-связи между нуклеофильной частицей и атомом углерода карбонильной группы и разрыв p-связи углерод-кислород. Атака нуклеофильной частицей атома углерода происходит с обеих сторон от плоскости карбонильной группы. Образовавшийся алкоксид-анион далее подвергается электрофильной атаке. Большинство реакций, характерных для карбонильных соединений, протекают по механизму нуклеофильного присоединения (реакции присоединения воды, спиртов, тиолов, синильной кислоты, аминов и их производных, альдольная конденсация и другие).
Реакции присоединения воды
Низшие альдегиды и кетоны хорошо растворимы в воде, наряду с образованием межмолекулярных водородных связей возможно протекание реакции гидратации – присоединения воды к карбонильному соединению. Реакционная способность альдегидов и кетонов убывает с уменьшением величины частичного положительного заряда на атоме углерода карбонильной группы. Это подтверждается данными о степени гидратации альдегидов и кетонов: формальдегид гидратирован более чем на 99,9%, ацетальдегид – приблизительно на 58%, ацетон – практически не гидратирован. Продукты реакции неустойчивы, существуют, как правило, только в растворе, при попытке выделить в свободном виде разлагаются на воду и карбонильное соединение.
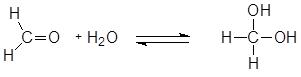
Механизм реакции включает нуклеофильную атаку альдегида молекулой воды, что приводит к образованию биполярного иона, который далее превращается в нестойкий двухатомный спирт.
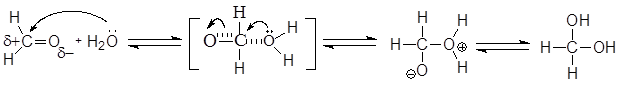
Гидратация кетонов возможна лишь в присутствии кислот или щелочей как катализаторов.
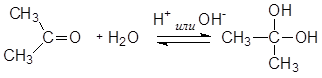
Механизм реакции гидратации при кислотном катализе:
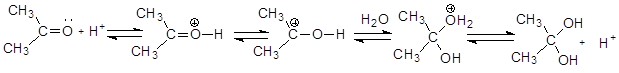
На первом этапе протон присоединяется к атому кислорода карбонильной группы (за счет неподеленной пары электронов кислорода) с образованием оксониевого катиона, который на следующем этапе превращается в карбкатион, легко (за счет целого положительного заряда на углероде) подвергающийся нуклеофильной атаке молекулой воды. Образующийся оксониевый катион стабилизируется отщеплением протона (возврат катализатора).
Механизм реакции гидратации при основном катализе:
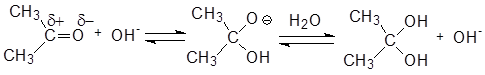
При проведении гидратации в щелочной среде гидроксид-ион атакует электрофильный атом углерода карбонильной группы с образованием оксониевого аниона, который далее стабилизируется путем отщепления протона от молекулы воды.
В отличие от большинства карбонильных соединений, 2,2,2-трихлорэтаналь (хлораль) легко реагирует с водой, образуя устойчивый продукт гидратации – хлоральгидрат, используемый в медицине и ветеринарии как успокаивающее и снотворное средство. Повышенная реакционная способность этого соединения объясняется сильным электроноакцепторным эффектом трихлорметильной группы, которая увеличивает эффективный положительный заряд на атоме углерода карбонильной группы, а также стабилизирует продукт реакции.
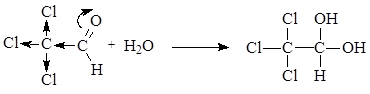
Реакции присоединения спиртов
В присутствии сухого хлороводорода альдегиды реагируют со спиртами, образуя ацетали. Промежуточно образующиеся полуацетали в большинстве случае в свободном виде выделить не представляется возможным. Необходимо отметить, что превращение полуацеталей в ацетали без кислотных катализаторов не происходит.
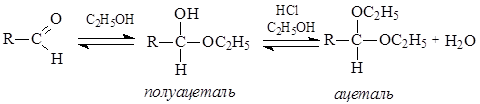
Превращение альдегидов в полуацетали происходит по механизму нуклеофильного присоединения АN, а последующее превращение полуацеталя в ацеталь представляет нуклеофильное замещение.
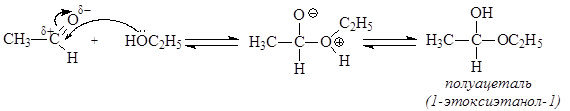
Необходимость использования кислотного катализа при превращении полуацеталей в ацетали обусловлена тем, что ОН-группа является плохо уходящей. Для превращения ее в хорошо уходящую группу – молекулу Н2О - используют кислоты в качестве катализаторов.
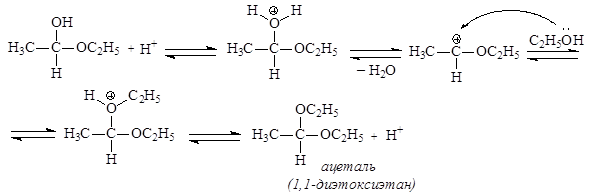
В случае реакций кетонов со спиртами положительный заряд на атоме углерода карбонильной группы оказывается недостаточным для непосредственной атаки молекулой спирта, и кетали одноатомных спиртов таким путем получить нельзя. Их получают с использованием ортоэфиров муравьиной кислоты.
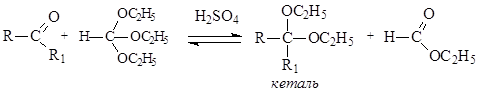
Реакции образования полуацеталей и ацеталей характерны для природных гетерополифункциональных соединений – углеводов. Моносахариды являются, как правило, полигидроксиальдегидами или полигидроксикетонами, внутри молекул которых между гидроксильной и карбонильной группами происходит взаимодействие, приводящее к образованию гетероцикла:

Циклические формы моносахаридов являются циклическими полуацеталями или циклическими полукеталями. Образование олигосахаридов и полисахаридов представляет собой реакцию образования ацеталя, повторяющуюся многократно:

Полисахариды, как ацетали, подвергаются гидролизу только в кислой среде.
Присоединение меркаптанов RSH к альдегидам и кетонам приводит к образованию, соответственно, тиоацеталей. Способность молекул меркаптанов эффективно атаковать атом углерода карбонильной группы кетонов отражает большую склонность RSH (по сравнению с ROH) к образованию эффективных нуклеофилов RS-, т.е большую кислотность тиолов по сравнению со спиртами.
Дата добавления: 2015-08-08; просмотров: 4982;
