Лекция № 7
Реакции нуклеофильного замещения в ряду карбоновых кислот и их производных
Карбоновые кислоты и их функциональные производные (галогенангидриды, ангидриды, сложные эфиры, тиоэфиры, амиды, соли) также содержат в своем составе карбонильную группу, однако для них характерны реакции нуклеофильного замещения, а не присоединения. Такой результат взаимодействия этих субстратов с нуклеофилами обусловлен их электронным строением.
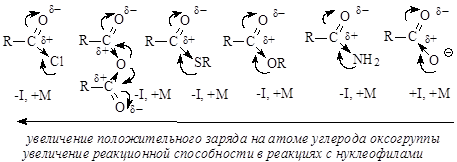
Величина положительного заряда, возникающего на атоме углерода оксогруппы, увеличивается с усилением электроноакцепторного характера заместителя (d+ возрастает с усилением отрицательного индуктивного эффекта по сравнению с положительным мезомерным эффектом). Отличием приведенных выше соединений от альдегидов и кетонов является то, что 2 электрона p-связи углерод-кислород участвуют в сопряжении с неподеленной парой р-электронов гетероатома (атомов галогена, серы, кислорода или азота), что приводит к повышению стабильности соединений. Нуклеофильное присоединение к карбонильной группе этих соединений приводило бы к изменению гибридизации атомных орбиталей углерода с sp2 на sр3 и разрушению системы сопряжения, уменьшению стабильности молекулы. Для сохранения сопряженной системы в реакциях с нуклеофилами после присоединения нуклеофильной частицы происходит отщепление уходящей группы и регенерация сопряжения. В итоге нуклеофильная частица оказывается связанной с ацильной группой – R-C=O, поэтому реакции производных карбоновых кислот называют реакциями ацилирования. Общая схема нуклеофильного замещения имеет вид:
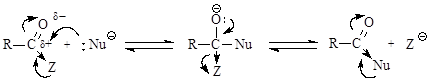
Реакционная способность соединений зависит от величины эффективного положительного заряда на атоме углерода карбонильной группы и от способности к отщеплению уходящей группы Z. В приведенном выше ряду функциональных производных карбоновых кислот справа налево (от солей к галогенангидридам) увеличивается положительный заряд на атоме углерода и увеличивается стабильность уходящей группы, т.е. способность к отщеплению. Реакции ацилирования с участием галогенангидридов карбоновых кислот идут практически необратимо, для связывания кислоты реакцию проводят в присутствии аминов – пиридина или триэтиламина. Уравнение реакции имеет вид:
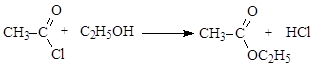
Механизм реакции:
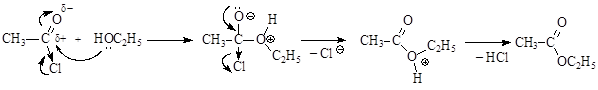
Ангидриды карбоновых кислот несколько менее реакционно способны в реакциях ацилирования вследствие меньшего положительного заряда на атомах углерода карбонильных групп. Меньший положительный заряд в сравнении с галогенангидридами возникает из-за того, что атом кислорода проявляет отрицательный индуктивный эффект по отношению к обеим карбонильным группам. При ацилировании спиртов ангидридами кислот, как и при ацилировании с помощью галогенангидридов, выделяющуюся кислоту связывают добавлением органических оснований.
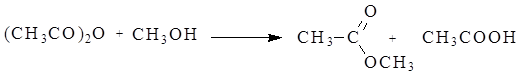
Механизм реакции:
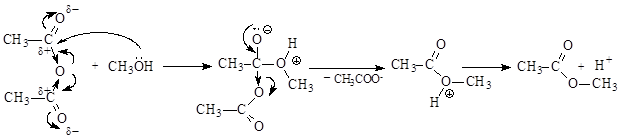
Ацилирование аминов проводят в избытке амина:
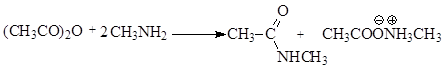
Механизм реакции аналогичен ацилированию спиртов.
Карбоновые кислоты и сложные эфиры карбоновых кислот являются существенно менее реакционноспособными ацилирующими агентами. Снижение реакционной способности обусловлено снижением эффективного положительного заряда на атоме углерода карбонильной группы из-за усиления электронодонорных свойств гидроксильной группы ОН у кислот или алкоксигруппы ОR у сложных эфиров в сравнении с ацильной группой или атомом галогена. Карбоновые кислоты, кроме электрофильного центра, имеют и другие реакционные центры:
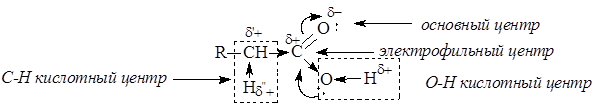
В отличие от альдегидов и кетонов, карбоновые кислоты имеют О-Н кислотный центр, за счет которого проявляют сравнительно сильные кислотные свойства. Сила карбоновых кислот зависит от величины эффективного положительного заряда на атоме углерода карбоксильной группы. Чем больше величина этого заряда, тем сильнее пара электронов атома кислорода гидроксильной группы вовлечена в р,p-сопряжение, тем сильнее поляризована связь и ослаблена связь О-Н, тем легче идет ее разрыв с образованием мезомерно стабилизированного карбоксилат-аниона:
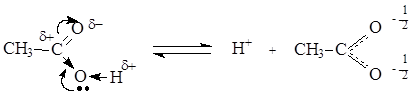
Именно из-за стабильности карбоксилат-анионов и легкости их образования карбоновые кислоты проявляют более сильные кислотные свойства, чем фенолы, тиолы и спирты. Величина эффективного заряда на атоме углерода карбоксильной группы и кислотные свойства зависят от характера радикала, связанного с карбоксильной группой: электроноакцепторные заместители усиливают кислотные свойства соединений, электронодонорные – ослабляют.
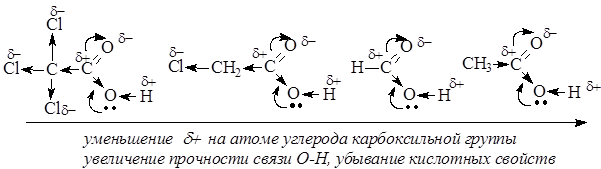
Реакционная способность карбоновых кислот в реакциях нуклеофильного замещения в сравнении с галогенангидридами, ангидридами, тиоэфирами понижена вследствие электронодонорных свойств ОН-группы, уменьшающей электрофильность атома углерода. Для увеличения электрофильности (эффективного положительного заряда) необходимо использовать кислотный катализ. Реакции этерификации карбоновых кислот и гидролиза сложных эфиров протекают в присутствии сильных минеральных кислот как катализаторов. В качестве катализатора часто используют серную кислоту.
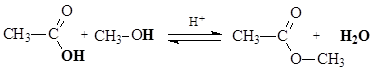
Механизм реакции:
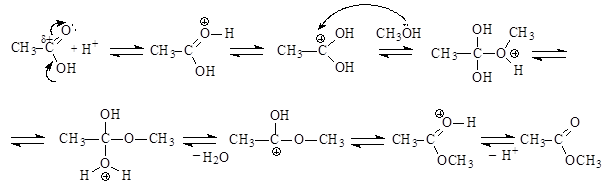
Присоединение протона к основному центру кислоты приводит к образованию карбкатиона - реакционноспособной электрофильной частицы, которая легко подвергается атаке нуклеофилом – молекулой спирта. Образовавшийся оксониевый катион, отщепляя воду, превращается в карбкатион, который регенерирует сопряженную систему путем отщепления протона, что приводит к образованию сложного эфира и возврату катализатора. Ионы водорода катализируют и прямую, и обратную реакции, равновесие реакции можно смещать, используя принцип Ле-Шателье.
Гидролиз сложных эфиров, катализируемый основаниями, протекает необратимо.

Механизм реакции:
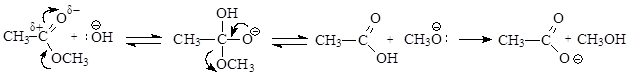
При щелочном гидролизе в результате присоединения нуклеофила – гидроксид-аниона – образуется оксониевый анион, который за счет одновременного образования p-связи углерод-кислород и разрыва s-связи кислород-углерод дает карбоновую кислоту и алкоголят-анион. Алкоголят-анион, являющийся сильным основанием, легко отщепляет протон от молекулы кислоты, в результате образуется молекула спирта и стабильный карбоксилат-анион.
В биологических объектах в качестве ацилирующих агентов выступают тиоэфиры и смешанные ангидриды кислот. Ацетилфосфат и родственные ему соединения образуются при расщеплении АТФ под действием карбоксилат-ионов. Ацетилкофермент А образуется в результате ферментативного расщепления замещенных ацетилфосфатов под действием кофермента А.
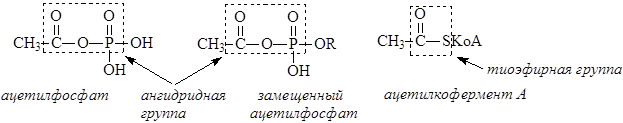
Дата добавления: 2015-08-08; просмотров: 4157;
