Углеводы. Моно- и олигосахариды
Углеводы – класс органических соединений, представители которого встречаются во всех живых системах. Было установлено, что многие представители этого класса соединений имеют молекулярную формулу типа Сn(H2O)m (n, m ³ 3), откуда и произошло название «углеводы», смысл которого ограничивается только этим формальным признаком. Углеводы образуются в результате фотосинтеза, осуществляемого в растениях:
nCO2 + mH2O = Сn(H2O)m + nO2
Животные организмы получают углеводы из растительных источников.
По отношению к гидролизу углеводы делятся на:
моносахариды – углеводы, которые не подвергаются гидролизу;
олигосахариды – углеводы, которые при гидролизе образуют от 2 до 10 моносахаридов;
полисахариды – углеводы, при гидролизе которых образуется свыше 100 моносахаридов.
Моносахариды, в свою очередь, классифицируют:
- по наличию альдегидной или кетогруппы – на альдозы и кетозы;
- по длине углеродной цепи – на триозы, тетрозы, пентозы и т.д.;
- по длине углеродной цепи и наличию альдегидной или кетогруппы – на альдотетрозы, кетопентозы, альдогексозы и т.д.
Моносахариды представляют собой полигидроксиальдегиды и полигидроксикетоны. Простейшей формуле С3Н6О3 соответствуют три изомерные триозы – кетотриоза и две энантиомерные альдотриозы:
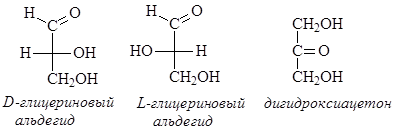
D- и L-глицериновые альдегиды можно рассматривать как родоначальные соединения двух рядов энантиомерных альдоз, дигидроксиацетон – как родоначальное соединение кетоз. Моносахариды обычно представляют собой твердые кристаллические вещества, хорошо растворимые в воде, умеренно растворимые в спирте и нерастворимые в неполярных растворителях – бензоле, хлороформе, эфире. Наибольшее биологическое значение среди моносахаридов имеют пентозы (рибоза, ксилоза) и гексозы (глюкоза, манноза, галактоза, сахароза). Принадлежность моносахаридов к D,L- рядам стереохимической номенклатуры определяется конфигурацией наиболее удаленного хирального центра.

D-рибоза и D-ксилоза, а также L-рибоза и L-ксилоза являются диастереомерами, отличающимися конфигурацией только одного хирального центра (третьего атома углерода). Диастереомеры, отличающиеся конфигурацией только одного хирального центра, называются эпимерами. D-рибоза и L-ксилоза, а также L-рибоза и D-ксилоза отличаются конфигурацией двух хиральных центров (второго и четвертого атомов углерода) и являются диастереомерами. D-ксилулоза и D-рибулоза друг по отношению к другу являются эпимерами, а по отношению к рибозе или ксилозе они являются структурными изомерами.
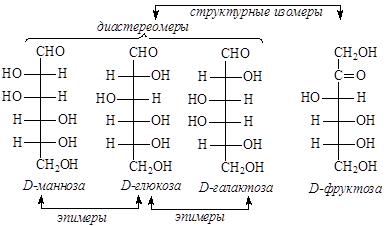
Аналогичная картина наблюдается и для гексоз: фруктоза (кетогексоза) является структурным изомером по отношению к альдогексозам. Альдогексозы, принадлежащие к одному стереохимическому ряду, по отношению друг к другу являются диастереомерами, а в случае отличия конфигурации только одного хирального центра образуют пары эпимеров.
Как известно, если в молекуле содержится несколько хиральных центров, то число стереоизомеров можно высчитать по формуле N = 2n (n – число хиральных центров). Однако для моносахаридов число стереоизомеров оказывается в два раза большим. В результате образования циклических форм моносахаридов появляется дополнительный центр хиральности – аномерный центр. В случае альдогексоз образование циклических форм происходит за счет взаимодействия альдегидной группы и спиртовой гидроксильной группы четвертого или пятого атомов углерода. Таким образом, циклические формы альдоз являются циклическими полуацеталями. Циклические формы моносахаридов обычно изображают с помощью формул Толленса или «перспективных» формул Хеуорса:
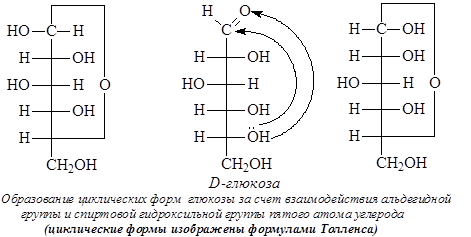
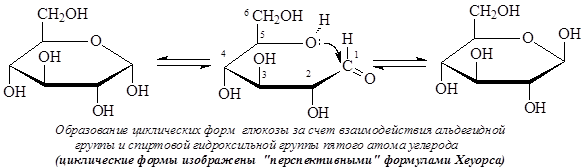
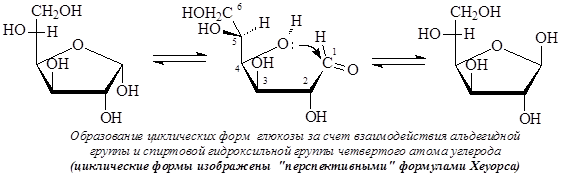
Атом углерода карбонильной группы в результате образования циклических форм оказывается связанным с четырьмя разными заместителями и таким образом возникает дополнительный хиральный центр – аномерный центр. Стереоизомеры, различающиеся только конфигурацией дополнительно возникшего хирального центра, называются аномерами. Аномеры представляют частный случай эпимеров и, как эпимеры, являются диастереомерами.
Для перехода от проекционных формул Фишера к формулам Хеуорса необходимо:
- произвести четное число перестановок у атома углерода, гидроксильная группа которого участвует в образовании циклического полуацеталя, таким образом, чтобы она оказалась внизу;
- записать с помощью формул Толленса циклические полуацетали, которые образуются за счет взаимодействия карбонильной группы и гидроксильной группы;
- заместители, которые в полученной формуле Толленса находятся справа от углеродного скелета, располагаются под циклом в формуле Хеуорса, заместители, находящиеся слева от углеродного скелета – располагаются над циклом в формуле Хеуорса.
Рассмотрим на примере образования циклических форм галактозы. Галактоза может образовывать шестичленные (пиранозные) и пятичленные (фуранозные) циклы. Для получения пиранозных форм галактозы:
- делаем четное число перестановок у пятого атома углерода, чтобы ОН-группа, участвующая в образовании цикла, оказалась внизу:
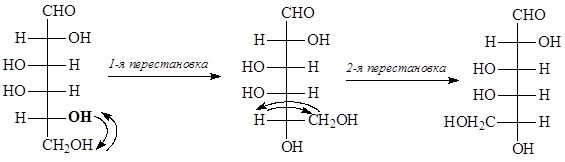
- записываем циклические полуацетали формулами Толленса:
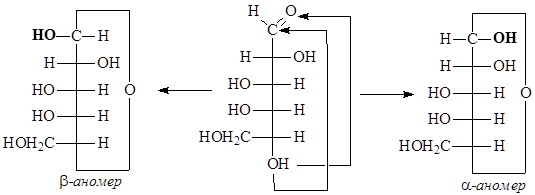
Образующиеся циклические полуацетали содержат дополнительно возникший хиральный центр – аномерный центр. Если конфигурация аномерного атома углерода совпадает с конфигурацией наиболее удаленного хирального центра в открытой форме моносахарида, то это – a-аномер, если не совпадает, – это b-аномер.
- Переходим от формул Толленса к перспективным формулам Хеуорса: в пиранозном цикле заместители, которые в полученной формуле Толленса находятся справа от углеродного скелета, располагаются под циклом в формуле Хеуорса, заместители, находящиеся слева от углеродного скелета, располагаются над циклом в формуле Хеуорса.
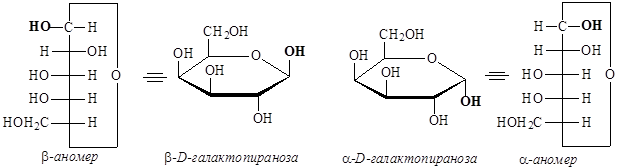
Аналогичным образом перейдем к фуранозным формам галактозы:
- делаем четное число перестановок у четвертого атома углерода, чтобы ОН-группа, участвующая в образовании цикла, оказалась внизу:
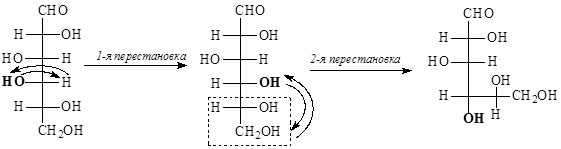
- записываем циклические полуацетали формулами Толленса:
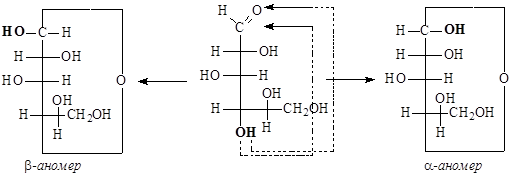
- переходим от формул Толленса к перспективным формулам Хеуорса:
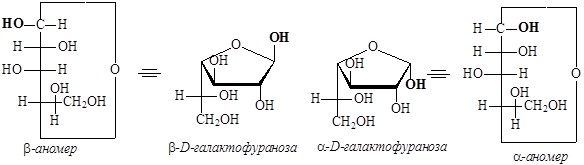
В зависимости от природы углевода (числа атомов углерода, наличия альдегидной или кето-группы), природы растворителя и условий кристаллизации в твердом состоянии моносахариды можно получить в виде a- или b-аномерных пираноз или фураноз. Было обнаружено, что в растворах моносахаридов происходит изомеризация, в результате которой устанавливается равновесие между пиранозными и фуранозными формами, взаимопревращение которых идет через оксо-форму. Такой вид изомерии называется цикло-оксо-таутомерия.
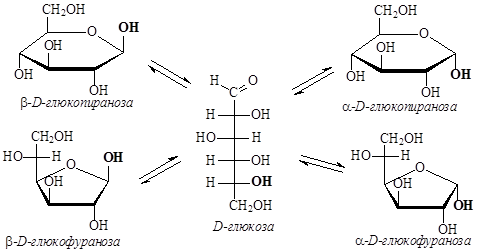
В водном растворе глюкозы преобладают пиранозные формы (32% – a-аномер, 68% – b-аномер), суммарное количество фуранозных форм и открытой формы составляет менее 1%. Подобные таутомерные превращения характерны для водных растворов моносахаридов и большинства дисахаридов. Преобладание в растворе глюкозы именно b-D-глюкопиранозы, а также ее распространенность среди природных моносахаридов объясняется устойчивостью шестичленного гетероцикла, в котором все гидроксильные группы находятся в экваториальном положении.
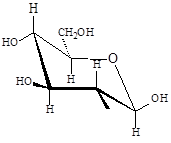
Цикло-оксо-таутомерия углеводов является причиной мутаротации. Мутаротация – изменение во времени угла вращения плоскости поляризации света растворами углеводов (со временем в растворах индивидуальных аномеров происходит постепенное изменение угла вращения плоскости поляризации света до достижения постоянной величины, что соответствует установлению равновесия между таутомерными формами).
Дата добавления: 2015-08-08; просмотров: 5126;
