Лекция № 9
Поли- и гетерофункциональные соединения. Биологически активные гетероциклические соединения. Таутомерия
Соединения, содержащие одну функциональную группу, называют монофункциональными, соединения с несколькими одинаковыми функциональными группами – полифункциональными, соединения с разными функциональными группами – гетерофункциональными. Большинство органических молекул, участвующих в процессах жизнедеятельности и являющихся родоначальниками различных групп лекарственных препаратов, относятся к поли- и гетерофункциональным соединениям.
К наиболее распространенным представителям полифункциональных соединений относятся многоатомные спирты, фенолы, многоосновные карбоновые кислоты, диамины.
Многоатомные спирты представляют собой бесцветные, вязкие жидкости, сладкие на вкус (этиленгликоль –яд), неограниченно растворимые в воде (этиленгликоль, глицерин) или бесцветные сладкие кристаллические вещества, хорошо растворимые в воде (ксилит, сорбит, маннит и др.). Наличие в молекулах этих соединений нескольких гидроксильных групп обусловливает проявление ими типичных химических свойств одноатомных спиртов. В реакции эти соединения в зависимости от условий вступают одной или всеми гидроксильными группами. В то же время наличие в одной молекуле нескольких электроноакцепторных групп ОН приводит к усилению кислотных свойств этих соединений:
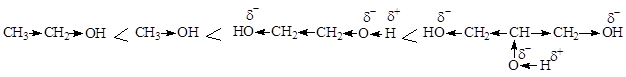
Качественной реакцией на многоатомные спирты является взаимодействие со свежеполученным гидроксидом меди(II), приводящее к образованию внутрикомплексных солей, имеющих интенсивный синий цвет.
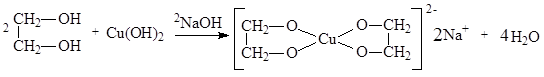
Этиленгликоль используется для изготовления антифризов, для получения полимеров, глицерин – для получения взрывчатых веществ, лекарственных препаратов, полимеров, как компонент смазок, кремов, парфюмерных и косметических препаратов, медицинских мазей, как мягчитель для тканей, кожи, бумаги.
Ксилит, сорбит получают восстановлением моносахаридов:

Ксилит, сорбит обладают желчегонным и послабляющим действием, организмом человека не усваиваются. Применяются вместо сахара в производстве кондитерских изделий для больных диабетом и ожирением.
Многоатомные фенолы – пирокатехин, резорцин, гидрохинон, пирогаллол входят в состав многих природных соединений. Эти соединения широко используются для получения лекарственных препаратов, взрывчатых веществ, красителей, как аналитические реагенты, как восстановители в фотографии.
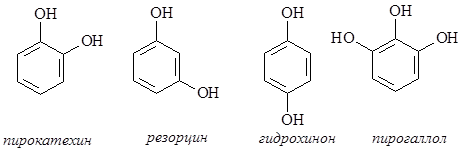
Многоатомные фенолы, подобно фенолу, являются слабыми ОН-кислотами, имеющими несколько констант диссоциации. Для них, как и для фенола, характерна реакция с FeCl3, приводящая к образованию окрашенных продуктов: пирокатехин дает зеленую окраску, резорцин – темно-фиолетовую, гидрохинон – черно-фиолетовую. Как и фенол, многоатомные фенолы легко вступают в реакции электрофильного замещения – подвергаются галогенированию, нитрованию, ацилированию. На воздухе легко окисляются, особенно легко происходит окисление пирокатехина и гидрохинона с образованием, соответственно, 1,2-бензохинона и 1,4-бензохинона.
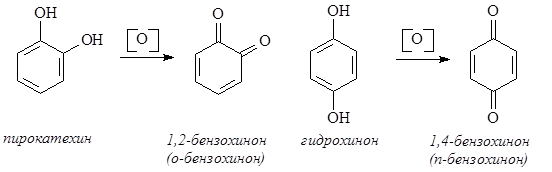
Хиноны содержат своеобразную систему сопряженных связей, называемую хиноидной группировкой. Она состоит из двух двойных связей в цикле и двух карбонильных групп. Соединения, содержащие хиноидную группировку, широко распространены в природе и могут выступать в качестве стимуляторов роста, антибиотиков, участвовать в окислительно-восстановительных процессах, сопровождающих дыхание.
Окислительно-восстановительные свойства системы хинон-гидрохинон играют важную роль в организме. По отношению к большинству органических субстратов эта система выполняет роль окислителя:
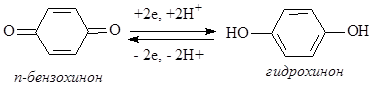
Принимая электроны от субстрата, замещенный хинон in vivo (в организме) превращается в соответствующий гидрохинон, который, в свою очередь, передавая электроны (через цитохромную систему) кислороду, обратно превращается в хинон.
Дикарбоновые кислоты – органические соединения, содержащие две карбоксильные группы. Дикарбоновые кислоты представляют собой кристаллические вещества, растворимые в воде. Первая константа диссоциации дикарбоновых кислот выше, чем у соответствующих монокарбоновых кислот, что особенно заметно у низших гомологов. Дикарбоновые кислоты проявляют все свойства монокарбоновых кислот, образуя как моно-, так и дипроизводные. При достаточной удаленности карбоксильных групп молекулы дикарбоновых кислот могут подвергаться дегидратации с образованием циклических ангидридов. Особенно легко этот процесс идет, если образуется стабильный пяти- или шестичленный цикл:
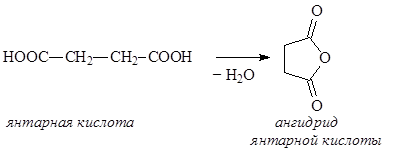
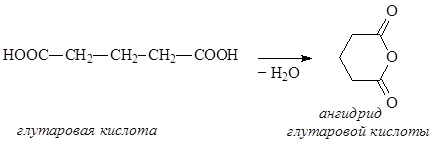
Диамины – органические соединения, содержащие в молекуле две аминогруппы. В природе чаще всего встречаются пента- и тетраметилендиамины Н2N(CH2)nNH2, где n = 5 и 4, содержащиеся в продуктах гнилостного распада белков – соответственно, кадаверин и путресцин. Эти диамины образуются при ферментативном декарбоксилировании ,соответственно, лизина и орнитина:

Кадаверин найден в спорынье, мухоморе, сыре, пивных дрожжах. Путресцин используется как исходное соединение для синтеза физиологически активных полиаминов – спермидина и спермина.
Аминоспирты классифицируют по расположению аминогруппы относительно гидроксильной группы:
a-Аминоспирты. Молекулы этих соединений содержат амино- и гидроксильную группу у одного и того же атома углерода. Такие соединения обычно очень неустойчивы и стабилизируются путем отщепления воды либо аммиака:
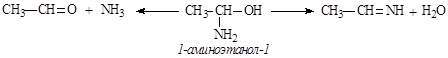
b-Аминоспирты. В молекулах этих веществ аминогруппа и гидроксильная группа содержатся у соседних атомов углерода:
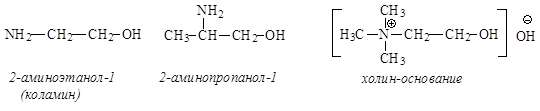
g-Аминоспирты. В молекулах этих соединений атомы углерода, связанные с аминогруппой и гидроксильной группой, разделены одним атомом углерода:
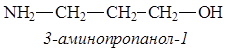
Наибольшее биологическое значение имеют b-аминоспирты – коламин и холин. Они и их производные являются структурными компонентами многочисленных биологически активных соединений: фосфолипидов, биогенных аминов, лекарственных препаратов.
Коламин может быть легко синтезирован из этиленоксида или этиленимина:
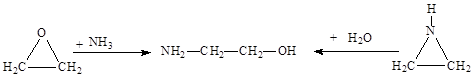
В организме коламин образуется в результате декарбоксилирования серина:
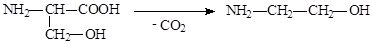
Холин-основание можно синтезировать из этиленоксида, действуя на него триметиламином или из коламина путем алкилирования галогеналканами:
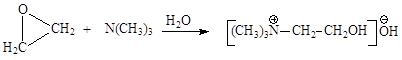
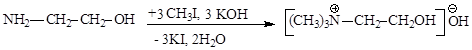
Холин физиологически активен и играет в организме человека и животных важную роль. Он понижает кровяное давление, участвует в регуляции жирового обмена, транспорте жиров, в метаболизме углеводов и белков.
Важную биологическую роль играет ацетилхолин (сложный эфир холина и уксусной кислоты), являющийся нейрогормоном. Он участвует в передаче нервных импульсов к клеткам нервных узлов и мускульным волокнам. Ацетилхолин в организме быстро гидролизуется под действием фермента ацетилхолинэстеразы до холина и уксусной кислоты. Его синтезируют из холина и ангидрида уксусной кислоты:
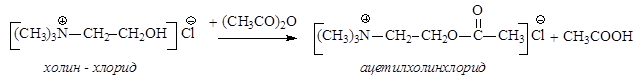
В организме ацетилхолин синтезируется из свободного холина и ацетилкофермента А:
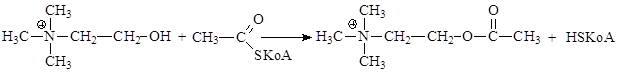
В медицинской практике широко используются производные b-аминоспиртов:
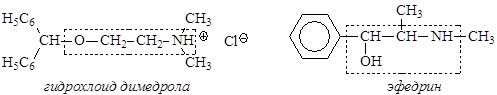
Димедрол используется в качестве противоаллергического препарата, обладает слабым снотворным действием. Эфедрин используется как сосудорасширяющее средство.
Большое значение имеют также другие представители гетерофункциональных соединений – аминофенолы, содержащие в своей структуре остаток двухатомного фенола – пирокатехина (катехола или 1,2-диоксибензола). Группу биогенных аминов, являющихся производными пирокатехина (катехола) и осуществляющих регуляцию функций эндокринных желез и передачу нервных импульсов, называют катехоламинами. Катехоламины рассматривают как гормоны и нейромедиаторы. К биогенным катехоламинам относятся дофамин, L-норадреналин и L-адреналин.
Основная функция дофамина – медиатор центральной нервной системы. Нарушение синтеза дофамина в мозгу обнаружено при болезни Паркинсона. Адреналин участвует в регуляции сердечной деятельности, обмена углеводов. L-Адреналин – гормон мозгового слоя надпочечников человека и животных (D-энантиомер в 15 раз менее активен). Взаимодействуя с адренорецепторами, вызывает сужение мелких кровеносных сосудов, повышение артериального давления, усиление работы сердца, расслабление мускулатуры бронхов и кишечника. Связываясь со специфическими рецепторами гликогенсодержащих клеток, стимулирует фермент аденилатциклазу, ответственный за синтез циклического аденозинмонофосфата. Последний, в свою очередь, активирует каскад ферментативных реакций, приводящих, в частности, к расщеплению гликогена и повышению содержания глюкозы в крови. Адреналин также стимулирует распад триглицеридов (жиров) в тканях и усиливает катаболические процессы. При эмоциональных переживаниях, особенно в стрессовых ситуациях, усиленной мышечной работе, охлаждении, понижении уровня сахара содержание адреналина в крови резко возрастает, что обеспечивает адаптацию организма к новым условиям.
Биосинтез этих катехоламинов осуществляется из фенилаланина через тирозин по схеме:

Гидрокси- и аминокислоты, как гетерофункциональные соединения, проявляют типичные свойства как карбоновых кислот, так и свойства спиртов или аминов. Однако для них характерны и специфические реакции, обусловленные взаимным расположением функциональных групп.
При нагревании a-аминокислоты подвергаются межмолекулярной дегидратации с образованием устойчивых шестичленных гетероциклов – дикетопиперазинов :
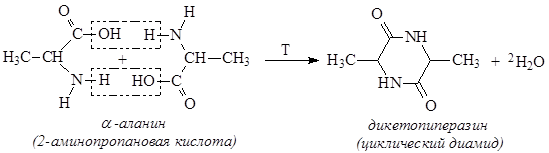
При нагревании a-гидроксикислоты образуют лактиды как результат межмолекулярного отщепления воды:
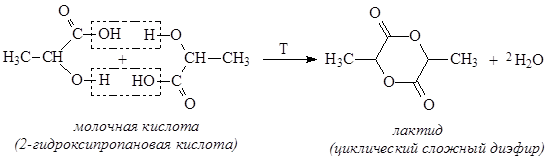
При нагревании a-гидроксикислот с серной кислотой происходит их превращение в карбонильное соединение и муравьиную кислоту, которая дальше разлагается на угарный газ и воду:
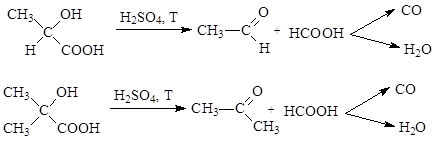
Нагревание b-амино- и b-гидроксикислот ведет к внутримолекулярному отщеплению аммиака или воды и образованию a,b-непредельных кислот:
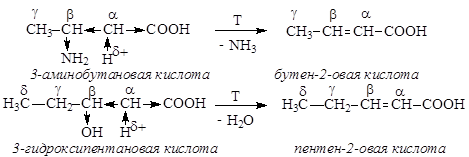
Легкость отщепления NH3 или H2O обусловлена возникновением в a-положении С-Н кислотного центра из-за влияния двух электроноакцепторных заместителей.
Нагревание g-амино и g-гидроксикислот приводит к образованию пятичленных гетероциклов – лактамов и лактонов - в результате внутримолекулярной дегидратации:
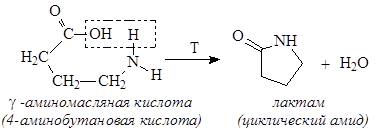
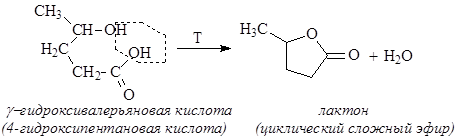
Оксокислоты часто встречаются в живых тканях, участвуют в процессах метаболизма. Наибольшее значение имеют a- и b-оксокислоты.
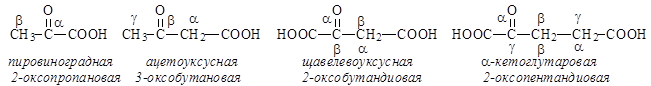
Как гетерофункциональные соединения, они проявляют свойства как кислот, так и кетонов или альдегидов:
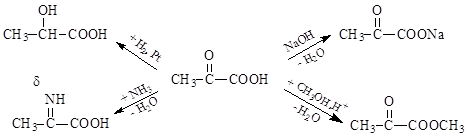
Оксо-группа, содержащаяся в оксокислотах, являясь электроноакцепторным заместителем, усиливает их кислотные свойства за счет проявления отрицательных индуктивного и мезомерного (при наличии сопряженной системы) эффектов:
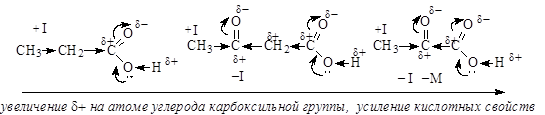
При наличии двух карбоксильных групп в молекулах оксокислот более сильные кислотные свойства проявляет та карбоксильная группа, ближе к которой расположена оксогруппа. Из-за более близкого расположения электроноакцепторного заместителя на атоме углерода такой карбоксильной группы возникает больший частичный положительный заряд и связь О-Н поляризуется в большей степени, что приводит к усилению кислотности. Присутствие в молекулах двух сильных электроноакцепторных заместителей приводит к возникновению С-Н кислотного центра, благодаря которому для оксокислот характерна кето-енольная таутомерия.
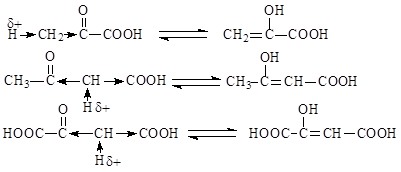
Обнаружить енольную форму кетокислот можно с помощью качественных реакций. При взаимодействии с FeCl3 енольный гидроксил (как и фенольный) дает характерное фиолетовое окрашивание, а при взаимодействии с бромной водой наблюдается ее обесцвечивание за счет протекания реакции по двойной связи.
Оксокислоты, в молекулах которых оксогруппа находится в a- или b-положениях, легко декарбоксилируются. a-Оксокислоты подвергаются окислительному декарбоксилированию под действием мягких окислителей (Cu(OH)2, Ag2O и т.п.):
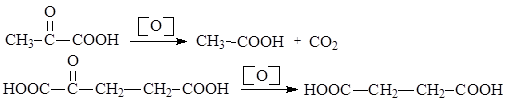
b-Оксокислоты неустойчивы и самопроизвольно декарбоксилируются при комнатной температуре.
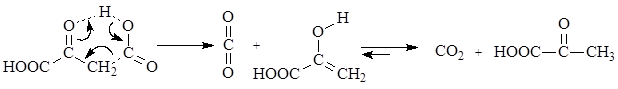
Легкость декарбоксилирования этих соединений обусловлена синхронным переносом протона от карбоксильной группы к карбонильной через образование внутримолекулярного переходного состояния.
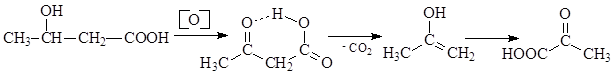
Ацетоуксусная кислота, образующаяся в организме в результате окисления b-оксимасляной кислоты, декарбоксилируется аналогичным образом.
b-Оксимасляная кислота, ацетоуксусная кислота и ацетон объединяются в клиническом анализе в группу «кетоновых тел». В моче здорового человека кетоновые тела содержатся в ничтожно малых количествах (не более 0,01г в сутки). В моче больных сахарным диабетом содержание кетоновых тел намного больше. Наряду с сахарным диабетом, кетоновые тела выделяются с мочой при голодании, исключении углеводов из пищи. Кетоновые тела можно обнаружить с помощью галоформной реакции. В эту реакцию вступают соединения, имеющие ацетогруппу СН3-С(О)-.
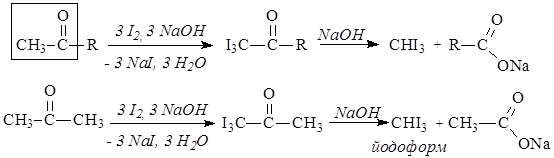
Галоформную реакцию используют в аналитических целях, констатируя образование йодоформа по характерному запаху.
Биологически активные гетероциклические соединения
Из огромного числа гетероциклических соединений необходимо отметить гетероциклические соединения, имеющие в своем составе один или несколько атомов азота. Эти соединения широко распространены в природе и являются структурной основой многочисленных физиологически активных веществ и лекарственных препаратов.
Пятичленные гетероциклы с двумя атомами азота
Представителями пятичленных гетероциклов с двумя атомами азота являются пиразол и имидазол:
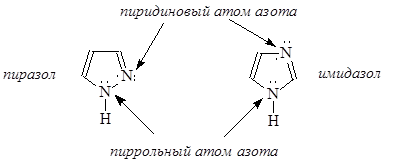
Оба соединения обладают ароматичностью, в единой сопряженной системе участвуют шесть электронов. Атомы углерода в сопряжение предоставляют по одному р-электрону, пиррольный атом азота в сопряжение отдает пару р-электронов, а пиридиновый атом азота – один р-электрон. Оба изомера обладают меньшей реакционной способностью в реакциях электрофильного замещения чем пиррол, что обусловлено электроноакцепторным характером пиридинового атома азота, уменьшающего электронную плотность в сопряженной системе. Оба гетероцикла проявляют амфотерные свойства, так как содержат одновременно кислотный и основный центры. Пиридиновый атом азота проявляет основные свойства за счет неподеленной электронной пары, не участвующей в создании сопряженной системы, пиррольный атом выступает как N-Н кислотный центр. Для обоих соединений характерно образование межмолекулярных водородных связей и прототропная таутомерия:
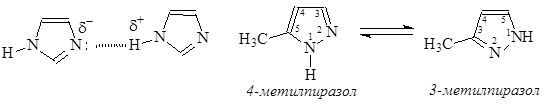
Из-за быстрого перехода протона практически невозможно выделить в индивидуальном виде изомеры замещенного пиразола и имидазола. Имидазольный цикл является структурным элементом разнообразных природных соединений, наиболее важными из которых являются аминокислота гистидин и продукт ее декарбоксилирования гистамин.
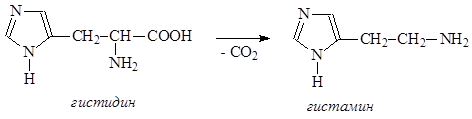
Гистидин выступает как катализатор в ферментативных реакциях за счет наличия в молекуле кислотного и основного центров. Гистамин принимает участие в передаче нервного возбуждения, активирует секрецию соляной кислоты слизистой желудка, снижает кровяное давление, при освобождении из связанного сотяния или введении в организм вызывает болевые ощущения и отеки. Гистидин также снижает гормональную активность коркового слоя надпочечников, в связи с чем применяется для лечения шизофрении.
Пиразольный цикл в составе природных соединений не обнаружен, однако структура пиразола лежит в основе жаропонижающих, болеутоляющих препаратов – антипирина, амидопирина, анальгина (первые два препарата сняты с производства и заменены более эффективными).
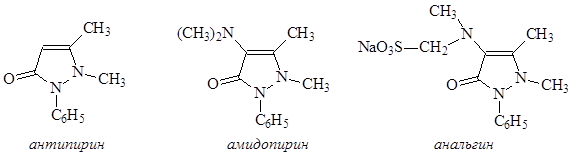
Структурной основой всех трех препаратов является пиразолон-5. Это соединение может существовать в виде трех таутомеров – двух кето-форм и енольной формы:
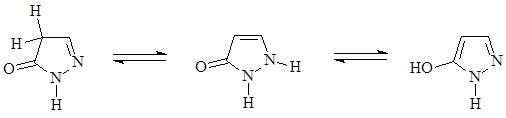
Шестичленные гетероциклы с одним и двумя атомами азота
Пиридин является p-дефицитным ароматическим соединением из-за наличия в цикле атома азота, проявляющего электроноакцепторные свойства.

Неподеленная пара р-электронов атома азота не участвует в сопряжении и ответственна за проявление пиридином основных и нуклеофильных свойств:
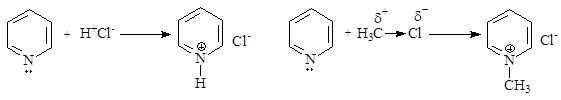
При взаимодействии с кислотами неподеленная пара электронов атома азота предоставляется для образования связи с протоном, т.е. пиридин выступает как акцептор протона и проявляет основные свойства. Если пара электронов атома азота предоставляется для образования связи с любым другим электрофильным атомом, то пиридин в этом случае выступает как нуклеофил. Пиридиновый цикл содержится как в составе отдельных лекарственных препаратов, так и является структурной основой разнообразных природных соединений.
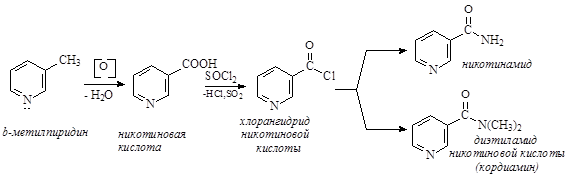
Никотиновая кислота и ее амид являются формами витамина РР, использующегося для лечения пеллагры. Кордиамин является стимулятором ЦНС. Производные изоникотиновой кислоты используются в качестве противотуберкулезных средств (тубазид, фтивазид).
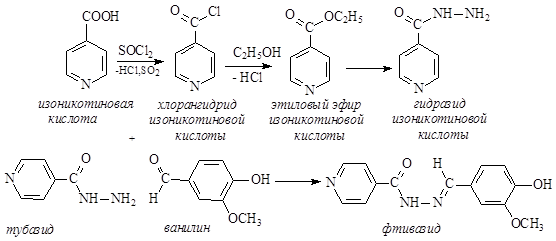
Никотинамидный фрагмент является структурным элементом НАД+ и НАДФ+ и обуславливает участие этих коферментов в качестве окислителей в окислительно-восстановительных реакциях.
Дата добавления: 2015-08-08; просмотров: 5983;
