Окисление и восстановление органических соединений
Окислительно-восстановительные процессы часто сопровождают протекание многих химических реакций, таких как реакции соединения, разложения, замещения, отщепления с участием неорганических и органических соединений. Внимание к окислительно-воссстановительным процессам объясняется тем, что зачастую они сопровождаются значительными тепловыми эффектами, что представляет несомненный интерес как для их промышленного использования, так и для понимания энергетических процессов, протекающих в клетке.
Необходимо отметить, что между процессами окисления и восстановления в неорганической и органической химии есть различия. Так, в неорганической химии под окислением понимают отдачу одного или нескольких электронов атомом, молекулой или ионом, под восстановлением понимают присоединение одного или нескольких электронов атомом, молекулой или ионом. В органической химии окислениемназывают процесс удаления атома водорода с образованием кратной связи или новой связи между атомом углерода и гетероатомом, более электроотрицательным, чем водород; восстановлением называют процесс образования новых связей с атомами водорода.
Примеры реакций восстановления:
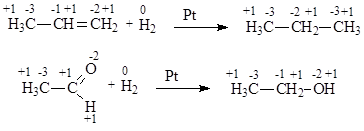
В этих случаях молекулы органических веществ восстанавливаются, принимая два атома водорода. Восстановление имеет место и в случае, когда молекула принимает гидрид-ион Н- и катион водорода Н+ (2Н× = Н- + Н+ = 2е- + 2Н+):
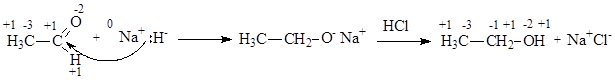
Процесс окисления органических молекул сопровождается отдачей двух электронов с образованием связи с двумя более электроотрицательными атомами:
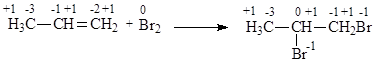
Окисляясь, органическая молекула может терять элетрон и атом водорода (электрон и атом Н эквивалентны гидрид-иону Н-) в результате образования связи с более электроотрицательным атомом:
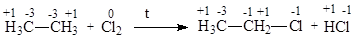
Процесс дегидрирования органической молекулы приводит к ее окислению, в результате молекула теряет два атома водорода (или гидрид-ион Н- и катион Н+, или 2е- и 2Н+) и образуется кратная связь:
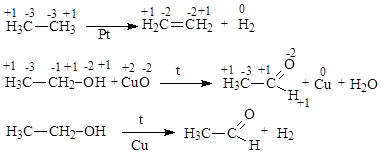
Процессы окисления и восстановления в организме происходят с участием различных коферментов, которые, выступая в качестве окислителей, ведут себя как акцепторы гидрид-иона (НАД+) или пары атомов водорода (ФАД), восстановленные формы этих коферментов в ОВР выступают как доноры гидрид-иона или молекулы водорода:
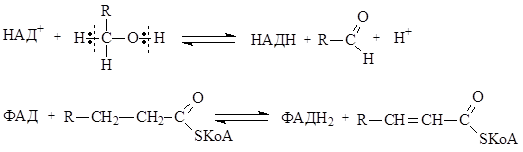
Дата добавления: 2015-08-08; просмотров: 5088;
