Энергетические уровни в атоме водорода
Сопоставляя второй постулат Бора hvn,k=Ek-En с формулой 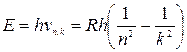 для энергии Е кванта света в спектре водорода, легко видеть, что энергия атома в стационарном состоянии должна иметь вид:
для энергии Е кванта света в спектре водорода, легко видеть, что энергия атома в стационарном состоянии должна иметь вид:

Таким образом, энергия атома водорода обратно пропорциональна квадрату номера орбиты, на которой находится электрон. Состояние электрона на первой орбите (n = 1) называют основным, а состояние с n = 2, 3, 4, - возбужденными.
Совокупность энергий Е1, E2, E3.., представляющих энергетические уровни атома водорода, представлена на рис. 32. Энергия электрона на бесконечно удаленной орбите (n=∞) принята за ноль. Энергия стационарного состояния (n=1) равна E1 = -Rh ≈ -13,6 эВ. Величина Eион= Rh — очевидно, является энергией ионизации водорода, то есть энергией, необходимой для отрыва электрона от атома (перевода электрона из стационарного состояния с п = 1 в состояние с п = ∞).
На рис. 32 показаны переходы с верхних уровней на нижние, сопровождающиеся излучением. Переходу на первый, самый нижний, уровень отвечает серия Лаймана (n= 1), переходу на второй уровень — серия Бальмера (n = 2) и т. д.
Аналогичные переходы с нижних уровней на верхние требуют затрат энергии, то есть поглощения квантов. Поэтому спектры поглощения тождественны спектрам испускания.
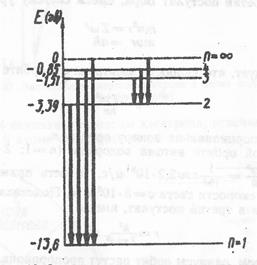
Рис. 32. Энергетические уровни в атоме водорода
Вопросы:
1. Укажите переходы, отвечающие границе спектра; границам серий.
2. Чему равна энергия ионизации атома водорода?
3. Как энергия ионизации связана с постоянной Ридберга?
4. Какой линии спектра соответствует уровень n=3?
Дата добавления: 2015-08-08; просмотров: 4823;
