Спектр атомов водорода
Спектр атомарного водорода (как и спектры других атомов) состоит из отдельных линий, сгруппированных в серии. Исторически первой была изучена так называемая серия Бальмера, полученная в спектре излучения водорода (рис. 29). Частоты, отвечающие линиям этой серии, выражаются формулой:
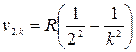 ; k = 3, 4, 5 …,
; k = 3, 4, 5 …,
где R=3,28985·1015, 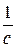 табличная величина (постоянная Ридберга).
табличная величина (постоянная Ридберга).
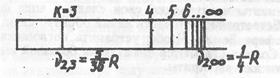
Рис. 29. Серия Бальмера в спектре водорода (п=2)
Наиболее яркой является линия с k =3, она называется головной линией серии Бальмера и имеет частоту v2,3= 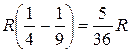 . Значению k=∞ отвечает граница серии Бальмера.
. Значению k=∞ отвечает граница серии Бальмера.
Позднее в спектре водорода были обнаружены и другие серии линий (рис.30). Серия Лаймана 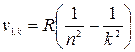 ; k = 2, 3... серия Пашена
; k = 2, 3... серия Пашена 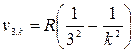 k=4, 5... и т.д. Таким образом, полный спектр испускания водорода состоит из множества серий (от n=1 до бесконечности), а в каждой серии имеется бесконечное число линий (от n+1 до бесконечности).
k=4, 5... и т.д. Таким образом, полный спектр испускания водорода состоит из множества серий (от n=1 до бесконечности), а в каждой серии имеется бесконечное число линий (от n+1 до бесконечности).
Все линии спектра могут быть описаны формулой:
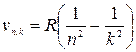 ; k =п + 1; n+2; ...,
; k =п + 1; n+2; ...,
где п— положительное число от единицы и выше.
Из этой формулы следует, что постоянная Ридберга представляет собой частоту, которая характеризует границу первой серии (серии Лаймана). Эта частота является наибольшей частотой, которую может излучить атом водорода. Граница серии Лаймана, т. е. v1,∞ =R является границей всего спектра водорода. В область малых частот, то есть влево на рис. 30, спектр простирается безгранично. Дискретность атомных спектров указывает на дискретность в строении самих атомов.
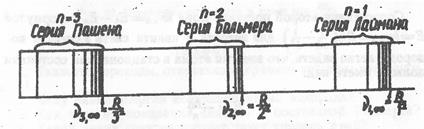
Рис. 30. Три серии в спектре водорода при n =1, 2, 3
Дата добавления: 2015-08-08; просмотров: 1202;
