Кинетика химических реакций.
Основные понятия химической кинетики.
Термодинамический расчет позволяет сделать вывод о возможности той или мной реакции и не дает информации о скорости ее протекания.
Химическая кинетика изучает, закономерности протекания химических реакций во времени, ее задачей является:
- определение скоростей химических реакций;
- определение пределов их протекания.
То есть такое соотношение исходных веществ и продуктов реакции может быть достигнуто при данных условиях ее проведения. Следовательно, при желании получить продукты реакции с высоким выходом, нужно определить условия реакции, при которых это возможно.
Гомогенные и гетерогенные реакции..
Гомогенные реакции – это реакции, протекающие в одной фазе.
Гетерогенные реакции – это реакции, протекающие на границе раздела фаз.
Фаза – часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачкообразно.
Пример: закрытый стакан с водой двухфазная система.
Фаза – это гомогенная часть гетерогенной системы.
Реагирующие системы характеризуются также по числу компонентов.
Компонент системы – это каждое индивидуальное вещество системы, находящееся в определенном физическом состоянии. Примером гомогенных систем служат любые реакции, проходящие в газообразном состоянии, то есть в газовой среде.
Гетерогенные реакции распространены в природе и технике и к ним относятся процессы сжигания твердого и жидкого топлива и процессы коррозии металла. Эти реакции протекают на границе раздела фаз.
Скорость реакции.
В ходе реакции постоянно изменяется количество реагирующих веществ в соответствии с их стехиометрическими отношениями, поэтому для контроля скорости достаточно определять количество хотя бы одного из реагирующих веществ, концентрацию всех других можно рассчитать из уравнения реакции, то все остальные будут изменяться в соответствии с уравнением:

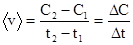 , где
, где

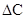 - изменение концентрации одного из участников концентрации;
- изменение концентрации одного из участников концентрации;

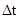 - промежуток времени, за который это изменение произошло;
- промежуток времени, за который это изменение произошло;
 v - скорость реакции.
v - скорость реакции.

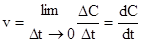 - мгновенная скорость реакции.
- мгновенная скорость реакции.
 Зависимость скорости реакции от концентрации выражается законом «действующих масс»: скорость реакции прямо пропорционально произведению концентраций реагирующих веществ, в степенях равных стехиометрическим коэффициентам в уравнениях реакций.
Зависимость скорости реакции от концентрации выражается законом «действующих масс»: скорость реакции прямо пропорционально произведению концентраций реагирующих веществ, в степенях равных стехиометрическим коэффициентам в уравнениях реакций.

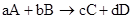

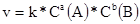 -кинетическое уравнение реакции, где
-кинетическое уравнение реакции, где
 k- константа скорости.
k- константа скорости.
 Идеальная скорость реакции, при С(А)=С(В)=1моль/л: k=v.
Идеальная скорость реакции, при С(А)=С(В)=1моль/л: k=v.
 Константа скорости зависит от природы реагирующих веществ, от температуры.
Константа скорости зависит от природы реагирующих веществ, от температуры.

Влияние температуры на скорость реакции грубо определяется правилом Вант Гоффа. При повышении температуры на каждые 10˚С скорость реакции в среднем увеличится в 2-4 раза.
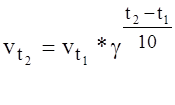
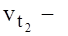 скорость реакции при температуре
скорость реакции при температуре 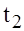 ;
;
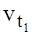 - скорость реакции при температуре
- скорость реакции при температуре 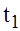 ;
;
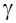 - температурный коэффициент реакции, который изменяется от 2 до 4.
- температурный коэффициент реакции, который изменяется от 2 до 4.
Точно, зависимость скорости реакции от температуры выражается правилом Аррениуса.
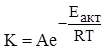
K – константа скорости
A – эмпирический коэффициент
e – основание натурального логарифма
Eакт – энергия активации
R – газовая постоянная
T – абсолютная температура
Энергия активации – избыточная энергия, необходимая для того, чтобы столкновения между реагирующими частицами были эффективными и заканчивались их взаимодействием.
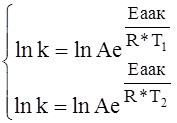
 Для того, чтобы для даннной реакции определить А и Еакт достаточно определить константу скорости при 2-х разных температурах.
Для того, чтобы для даннной реакции определить А и Еакт достаточно определить константу скорости при 2-х разных температурах.
Химическое равновесие.
Реакция может протекать как в прямом, так и в обратном направлении.
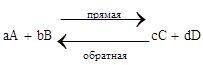
Кинетическое уравнение для прямой и обратной реакции

Состояние реакции системы, при котором скорость прямой реакции равна скорости обратной, называется состоянием химического равновесия. Любая реакция, протекающая в данных условиях в определенный момент времени достигнет состояния равновесия. Состояние равновесия характеризует величина – константа равновесия (Кр).
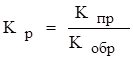
Константы равновесия показывает, что в условии равновесия концентрации всех веществ взаимосвязаны, их называют равновесными. Кроме того, если К>1, то в условии равновесия в реакционной смеси преобладают продукты реакции, а если K<1 – исходные вещества. Следовательно, при определении условий обеспечивающих равновесия с K>1, определяют возможность использования данной реакции для получения продуктов реакции.
Смещение равновесий.
Всякое равновесное состояние определяется постоянством условий (T, p, V, концентрации). Если изменить одно из этих условий, равновесие будет нарушено. Скорость прямой не равно скорости обратной реакции. Но с течением времени будет достигнуто новое состояние равновесия, т. е. скорость прямой равно скорости обратной реакции, но это будут другие скорости, Кр1= Кр2, изменятся равновесные концентрации (С1(A)≠C2(A)). Система из одного состояние равновесия перейдет в другое состояние равновесия (смещение равновесий). Поиск условий проведения реакции, при которых константы равновесия больше единицы, сводится к смещению равновесий. Для этого используется принцип Ле-Шателье. Если на систему, находящуюся в равновесии, оказывают воздействие (изменение концентрации, температуры, давления или объёма), то система увеличивает скорость тех процессов, которые направлены на снижение уровня произведенного на систему воздействия.
В настоящее время реакции проводятся с помощью катализатора. Катализатор – это вещество, которое увеличивает скорость реакции за счет образования промежуточных продуктов реакции (реакция проходит в несколько стадий, причем каждая стадия имеет меньшую энергетическую активацию). В продуктах реакции катализатор отсутствует. В результате реакция не изменяется, однако, его поверхность дезактивируется, и периодически проводят его регенерацию (восстанавливают активность катализатора).
Дата добавления: 2015-08-08; просмотров: 1650;
