Энергетические эффекты химических реакций. Внутренняя энергия и энтальпия. Стандартная энтальпия образования вещества.
Химическая реакция – это процесс в ходе, которого из одних веществ образуются другие. 
 аА+bB=cC+dD ,где
аА+bB=cC+dD ,где
 А, В – формулы исходных веществ,
А, В – формулы исходных веществ,
 C, D – формулы продуктов реакции,
C, D – формулы продуктов реакции,
 a, b, c, d – стехиометрические коэффициенты в уравнении реакций, подобранные в соответствии с законом сохранения масс реагирующих веществ (она отражает количество реагирующих веществ).
a, b, c, d – стехиометрические коэффициенты в уравнении реакций, подобранные в соответствии с законом сохранения масс реагирующих веществ (она отражает количество реагирующих веществ).
В ходе химических реакций происходит разрушение одних химических связей и образование других. На разрыв связи расходуется энергия, а при образовании – выделяется. В связи с этим любая химическая реакция сопровождается энергетическим эффектом. Т.е. выделением или поглощением энергии. Эта энергия может быть затрачена или получена в различных видах:
1. тепловой;
2. электрический;
3. световой (электромагнитное излучение).
Задачами термохимической динамики являются:
1. определение физических эффектов химических реакций, в частности тепловых;
2. изменение свободной энергии системы с целью оценки возможности протекания данной реакции при данных условиях.
Основные понятия и законы в термодинамике.
Система – произвольно выбранная совокупность тел , находящаяся во взаимодействии. Основное свойство, которой является результат взаимодействия образующих ее частей.
Изолированная система –система, не обменивающаяся со средой ни веществом, ни энергией.Закрытая системаобменивается со средой энергией, но не обменивается веществом. Если закрытая система получает энергию, она положительна, если отдает – отрицательна. Открытая система обменивается со средой веществом и энергией. Закрытые и изолированные системы создаются человеком с определенными целями. Химические реакции, как правило проводят в закрытых системах. Состояние системы характеризуется параметрами состояния: давления, температуры, объема и компонентный состав, т.е. какие вещества и в каком количестве в системе присутствуют.
Внутренняя энергия системы (U) – это общий запас энергии системы, включающий энергию поступательного и вращательного движения молекулы, энергию внутримолекулярных колебаний атома, энергию движения электронов в атоме, внутриядерную энергию, т. е. все виды энергии кроме кинетической энергии движения системы как целого и его потенциальной энергии. Внутренняя энергия является функцией состояния системы, U(P,V,T, 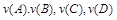 ). Можно охарактеризовать состояние системы параметрами (P1,V1,T1,
). Можно охарактеризовать состояние системы параметрами (P1,V1,T1, 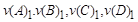 ).
).
Процесс в ходе которого меняется хотя бы один из параметров называется термодинамическим процессом. И в ходе такого процесса изменяться внутренняя энергия системы P2,V1,T1, 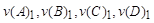 .
.
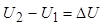
Изменение внутренней энергии не зависит от пути перехода системы из первого состояния во второе, а зависит только от начального (U1) и конечного (U2) значения внутренней энергии. Если закрытая система переходит из состояния 1 в состояние 2, она обменивается с внешней средой теплотой и механической энергией, затрачиваемой механической работой.
Закон сохранения энергии: теплота, подводимая к системе, затрачивается на изменение внутренней энергии и совершение работы, где работа, действующая против всех сил действующих на систему.
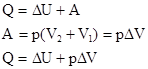
Тепловые эффекты химических реакций.
Если в закрытой термодинамической системе протекает химическая реакция 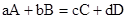 , то в начальном состоянии у нас имеется а моль и b моль вещества A, B, что соответствует закону внутренней энергии U
, то в начальном состоянии у нас имеется а моль и b моль вещества A, B, что соответствует закону внутренней энергии U 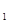 , при P, T=const; в конечном состоянии в системе при данных T и P присутствует c, d моль веществ C и D – это соответствует запасу внутренней энергии U
, при P, T=const; в конечном состоянии в системе при данных T и P присутствует c, d моль веществ C и D – это соответствует запасу внутренней энергии U  , при P, T=const. Тепловой эффект реакции при температуре Т – это тепловая энергия Q, которая выделяется или поглощается при взаимной исходности веществ, причем реагенты и продукты реакций находятся при одной и той же температуре.
, при P, T=const. Тепловой эффект реакции при температуре Т – это тепловая энергия Q, которая выделяется или поглощается при взаимной исходности веществ, причем реагенты и продукты реакций находятся при одной и той же температуре.
Тепловые эффекты реакции при постоянном объеме (Qv)
V=V2=const;
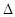 V=0, то Qv=
V=0, то Qv= 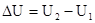 ;
;
Если 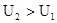 , то Qv>0
, то Qv>0 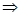 тепло поглощается (эндотермическая реакция).
тепло поглощается (эндотермическая реакция).
Если 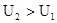 , то Qv<0
, то Qv<0 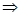 тело выделяется (экзотермическая реакция).
тело выделяется (экзотермическая реакция).
Рекации при V=const могут идти в следующих случаях:
1. в закрытом сосуде (тепловая бомба);
2. между твердыми телами и жидкостями без выделения газа;
3. между газами, если число молекул остается постоянным.
Реакции при P=const (тепловой эффект Qp):
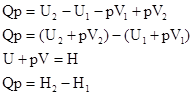
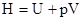 - энтальпия теплосодержания системы – это сумма внутренней энергии и произведения объема системы на внешнее давление.
- энтальпия теплосодержания системы – это сумма внутренней энергии и произведения объема системы на внешнее давление.
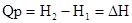 - изменение энтальпии (изменение внутреннего содержания системы).
- изменение энтальпии (изменение внутреннего содержания системы).
Сумма внутренней энергии и произведение объёма на внешнее давление называется энтальпией ( 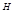 ), имеет размерность энергии и обозначается теплосодержанием системы. Энтальпия, как и внутренняя энергия, является функцией состояния. Её внутреннее значение
), имеет размерность энергии и обозначается теплосодержанием системы. Энтальпия, как и внутренняя энергия, является функцией состояния. Её внутреннее значение 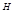 неизвестно, поэтому практическое значение имеет
неизвестно, поэтому практическое значение имеет 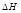 (изменение энтальпии) в ходе термодинамического процесса или входе химической реакции.
(изменение энтальпии) в ходе термодинамического процесса или входе химической реакции.
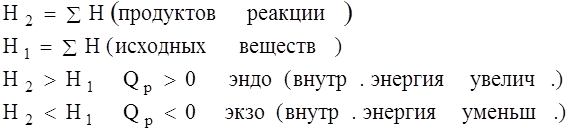
Дата добавления: 2015-08-08; просмотров: 6886;
